
儿童胸科麻醉:肺隔离的气道管理及术后镇痛
儿童胸科手术及相关麻醉技术日益进步。区分小儿胸科麻醉与其他小儿麻醉学科的2个重要领域包括单肺通气方法和特定区域阻滞技术,后者为术后疼痛管理的最佳手段。单肺通气技术在过去25年中发生了显著变化,特别是许多不同的支气管封堵器广泛普及和常规使用,在某些情况下可取代或者作为旧的方案,如支气管内插管和双腔气管插管的一种替代方案[1-3]。此外,除局部浸润和椎管麻醉外,区域阻滞技术在术后镇痛方面的潜在贡献也得到了越来越多的理解和赞赏。这篇简短的综述重点介绍了非心脏胸科手术儿童接受单肺通气的气道管理方法,以及术后疼痛管理的区域阻滞技术和多模式镇痛策略。
1 儿童单肺通气
儿科患者的非心脏胸科手术需要根据年龄或特定设备支持来实现单肺通气。由于这种病例即使在大型儿童医院也较为少见,几乎没有前瞻性试验以指导临床医生为单肺通气选择合适的技术。因此,有关该主题的大部分可用文献都基于病例报告或较小的病例系列[2-6]。
单肺通气或肺隔离的适应证通常分为2种:绝对适应证和相对适应证。绝对适应证包括使用肺隔离技术来防止健侧肺被来自外伤或感染状态的患侧肺的血液或其他分泌物污染。支气管胸膜瘘也是绝对适应证,因为在正压通气的情况下,空气优先通过一侧支气管胸膜瘘排出,使得双侧肺膨胀不足,从而导致通气不足,需要肺隔离以维持足够的氧合和通气。相对适应证包括使用肺隔离技术隔离或使患侧肺萎陷以便于进行开胸或胸腔镜手术。
2 单肺通气的生理学
成人与儿童单肺通气的生理学有很大差异。在成人患者中,缺氧性肺血管收缩和侧卧位产生的流体静压的组合机制形成了最佳的通气/血流配比,血液优先分配到通气更好的肺[7]。儿童患者由于体型更小,侧卧位时的上肺和下肺之间的静水压梯度也更小,即使存在持续的缺氧性肺血管收缩,肺血流分布也更均匀。此外,胸廓的弹性会导致下肺受压,进一步降低通气量,导致整体通气-灌注不匹配[1,8]。最终,可能会使儿童手术中低氧血症的风险增加。即便如此,在大多数临床案例中,大多数儿童甚至相当小的幼儿似乎都可以耐受单肺通气。例外往往是在存在活动性或持续性肺炎(例如坏死性肺炎)的情况下,由于各种原因可能会严重影响局部肺血流、通气及灌注,从而在单肺通气过程中显著增加低氧血症的风险。
3 单肺通气的策略
儿童单肺通气的技术和设备的选择可能因儿童的体型和临床医生对于特定设备或技术的上手程度而显著不同。最常见的技术包括:支气管内或主支气管插管、放置支气管封堵器或双腔管。
3.1 支气管内插管
主支气管插管或支气管内插管仍然是小儿实现单肺通气的常用方法。整套技术在大多数情况下都很容易实现,这是其优点。然而这种方法的主要问题是婴儿气管支气管树的解剖学限制。在许多情况下,主支气管明显小于环状软骨水平的气管,在某种程度上,适用于正常气道管理的气管插管实际上可能太大而无法进入给定的主支气管。当试图将气管插管放入左主支气管时尤其如此,在大多数儿童中,左主支气管比右主支气管更窄,该现象与年龄无关。因此,很多时候临床医生不得不选择比根据儿童年龄计算的合适尺寸小一半的气管插管。支气管内插管的导管尺寸汇总见表1。
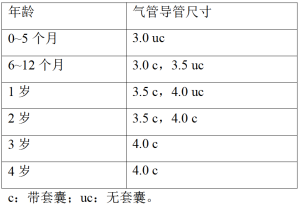
Full table
放置策略包括将气管导管通过软性光纤探头置入目标的主支气管,通过听诊盲目推进,或使用X射线透视将气管插管导入所需的支气管[9]。支气管内插管的缺点包括:无法从单肺通气快速切换到双肺通气,气管内导管腔被血液或分泌物阻塞导致通气不足和低氧血症(图1),尺寸过大的气管导管会损伤支气管,最后,由于气管插管进入所需的支气管,上叶靠近隆突而堵塞上叶,导致通气不足和潜在的低氧血症(图2)。临床医生应该意识到,在临床医生将气管内导管插入右主支气管时,这种情况更容易发生,因为右上叶的开口比左上叶的开口更靠近隆突。
3.2 支气管封堵器
另一种可用于幼儿肺隔离的方法是放置带导管的闭塞球囊,该球囊充气后可以闭塞手术侧的主支气管。目前有多种支气管封堵装置可用,包括Fogarty导管(Edwards Life Sciences,Irvine,CA,USA)、theArndt (Cook Medical,Bloomington,IN,USA)、Fuji Uniblocker™ (Ambu,Columbia,MD,USA)、Univent™ Tube (Fuji Systems,Tokyo,Japan)管和EZ-Blocker (Teleflex Inc.,Wayne,PA,USA)。其中记录最完整的可能是Arndt支气管封堵器,它有3种尺寸:5Fr、7Fr和9Fr(图3)。放置方法可能因设备而异,但在幼儿中,通常放置于气管导管外;较大的儿童可以放置于气管导管内。表2总结了设备尺寸、年龄和管内/外放置的适应证。
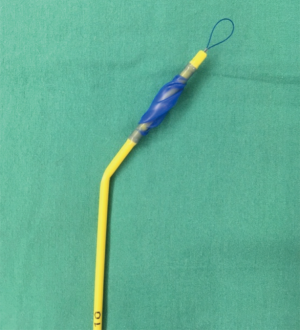
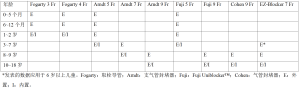
Full table
管外放置首先通过对患者进行诱导,然后进行喉镜检查来完成。通常,首先放置封堵器,然后将气管内导管插入患者的声门。一旦就位,封堵器可以通过软性纤维支气管镜的直视或透视进行定位。准确放置的主导技术因素之一包括确保封堵器有足够的头/尾移动性,以允许封堵器垂直移动以到达理想位置,同时支持足够的通气。目前有许多关于封堵器的不同置入方法的描述,对这些的详细描述超出了本综述的范围[2-3,5]。
使用支气管封堵器的优点包括能够从单肺通气快速过渡到双肺通气,正确放置时隔离严密。此外,这种技术可以在低至2.5 kg公斤左右的幼儿身上实施。缺点包括封堵器置入的技术难度和术中封堵器移位导致肺隔离效果消失而需要进行术中重新放置[3]。
其他可用于儿童的基于支气管封堵器的新型设备包括Univent管和EZ封堵器[10-12]。Univent管是一种支气管封堵器,它与单腔气管导管相连接,该装置通过喉镜放置,同时使用软性纤维支气管镜在直视下将封堵器从设备中推进到所需的主支气管中。不幸的是,即使是最小的Univent管也与6.0号的气管插管相关联,限制了其在6~7岁以下儿童中的使用。另一方面,EZ封堵器是一种以7F导管为基础的装置,带有2个独立的闭塞球囊,设计用于放置在隆突上(图4)。一旦就位,可以选择所需要的球囊充气以隔离患侧肺。管外放置方法的最新进展使该装置可用于6岁以下的儿童[10-11]。
3.3 双腔管
双腔气管插管仍然是成人实施单肺通气的中流砥柱。然而在儿童中,它们的尺寸限制了其在8岁以下儿童中的使用,甚至是一些病例中更大年龄的患儿。在临床实践中,26F的双腔管(可用的最小双腔管)的外径,相当于6.5号带套囊的气管插管的外径,大多数临床医生仍然认为它对于10或11岁以下的儿童而言尺寸过大,尽管一些文献推荐可以用于年幼的儿童[13]。为学龄儿童置入合适尺寸的双腔管的操作技巧与在成人患者中的操作相似。优点包括可靠的隔离、术中位置稳定、可快速在双肺通气与单肺通气之间切换,以及在发生顽固性低氧血症时能够轻松吸引或施加持续气道正压。缺点包括潜在的气管支气管损伤的风险和相对较大的尺寸。
4 术后疼痛管理概述
对于所有接受胸外科手术的患者而言,术后疼痛管理都是围手术期路径的重要组成部分。此外,有效的管理策略除了可以减轻疼痛和不适之外,还可以降低患者呼吸系统并发症的发生率,但没有研究在儿科患者中证实这一点。在儿科患者中进行研究以确认胸腔手术行区域阻滞的价值的挑战之一是,对幼儿疼痛的评估通常难以以有意义且可重复的方式进行量化,因此需要研究人员观察其他替代结果,如心率或胃肠道功能恢复情况,然而这些指标并没有特异性。对于年龄较大的儿童,有更多的自我描述选项,包括FLACC量表(即面部、腿部、活动、哭泣、是否能被安抚[14])、行为评估和父母对孩子不适的评估。然而,即使困难重重,在住院期间定期评估这些患者的疼痛仍然很重要,以便在必要时进行治疗方案的调整[15]。
在术后的多模式疼痛管理阶段,非甾体类抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDS)和扑热息痛应定时给药,而不是必要时给药(PRN),以确保维持治疗量的血清药物水平,这可以通过区域阻滞技术进一步补充或改进。然而,如果没有进行区域组阻滞或阻滞失败不能提供足够的镇痛,应开具阿片类药物来帮助控制术后疼痛。
4.1 局部区域镇痛
现如今儿童区域阻滞技术被认为是安全的[16],并且经常用于各种手术环境中的术后镇痛[17-18]。儿科区域麻醉网络(Pediatric Regional Anesthesia Network,PRAN)的最新数据[19]表明:儿童区域阻滞相关的不良事件风险与成人患者中观察到的风险相当。然而,与成人不同的是,儿童经常在全身麻醉下进行区域阻滞,以提高服从度并减少患者在阻滞进行期间的移动。这种做法被认为是安全的,并已被欧洲和美国区域麻醉学会作为标准化的常规操作[17]。有趣的是,婴儿需要比成人更高的相对剂量的局部麻醉剂来实现神经阻滞。然而,由于血浆蛋白结合率低和内在清除率降低,婴儿也承受了较高的神经系统或心脏毒性风险[16,20]。幸运的是,婴儿局部麻醉全身毒性(local anesthetic systemic toxicity,LAST)的发生很少见,但一旦发生,则必须及时用20%的脂肪乳剂进行治疗(图5)。鉴于这些相互矛盾的问题,临床医生不应该仅依靠单一的镇痛策略来管理小儿胸科手术患者的术后疼痛,而应实施多模式镇痛方案。
4.2 硬膜外镇痛
胸段硬膜外镇痛(thoracic epidural analgesia,TEA)常用于接受非心脏胸外科手术的儿童。2种最常见的导管放置方法包括在T3~T7节段,通过硬膜外针直接放置或通过在骶尾部裂孔水平插入硬膜外导管,然后在透视引导下到达胸段硬膜外腔(图6)。给药方法包括单次负荷量或连续输注局部麻醉药。在直接放置硬膜外导管的方法中,硬膜外腔通常可以直入到达,因为体表标志易触及、皮肤和硬膜外腔之间的距离较短以及脊柱解剖结构较为有利。类似于成人,临床医生应使用空气阻力消失或盐水阻力消失技术来识别硬膜外腔[17]。除这些更传统的方法之外,一些中心现在正在使用超声来帮助硬膜外针的置入,使用实时成像来获得针头和导管的体内动态视图[21]。此外,超声也已用于经骶尾部硬膜外导管置入的可视化[22]。
用于儿科患者硬膜外输注的常用局麻药包括布比卡因、罗哌卡因和/或左旋布比卡因(表3)。除连续输注外,罗哌卡因还可以以患者自控硬膜外镇痛(patient controlled epidural analgesia,PCEA)模式给药。例如使用浓度为0.1%~0.2%的上述局部麻醉剂之一,使用0.1 mL/kg的单次负荷量,锁定间隔为10 min,背景输注量为0.1 mg/kg/h。此外,可乐定(0.5~1 mcg/mL)、吗啡(5~10 mcg/mL)或芬太尼(2~5 mcg/mL)也可用作硬膜外输注药物中的佐剂。
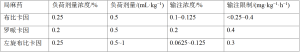
Full table
4.3 胸椎旁阻滞
在许多情况下,接受胸外科手术的患者中,胸椎旁阻滞(thoracic paravertebral block,TPVB)被认为是TEA的替代方案[23]。与成人一样,该技术通常在超声引导下进行[24]。不幸的是,在单次注射的个体局麻药剂量方面几乎没有文献可以参考。此外,在实现最大镇痛效果所需的注射部位数量方面也没有明确的规定。最近,作为871名患者的大型队列的一部分,Vecchione等[25]对118名在开胸手术后接受胸椎旁置管进行术后疼痛管理的患者进行了研究。此外,他们还报告了在35名接受电视辅助胸腔镜检查的患者中单次TPVB的经验。在该研究中,他们仅观察到1名未接受胸外科手术的患者出现严重并发症。这种并发症被记录为局部麻醉药单次负荷量后的短暂癫痫发作和低氧血症。轻微并发症的总体发生率为13.2%,尽管这是在所有接受TPVB的患者中,而不仅仅是那些接受胸外科手术的患者。轻微并发症包括局部导管移位、局部导管闭塞或渗漏、置管部位少量出血,以及在某些情况下由于导管敷料引起的皮肤刺激。TPVB也已成功地用于漏斗胸Nuss手术后儿童的疼痛管理[26-27]。
4.4 肋间神经阻滞
肋间神经阻滞(intercostal nerve block,ICNB)是一种较旧的区域阻滞技术,可用于开胸手术和视频辅助胸腔镜手术后的疼痛控制。肋间神经阻滞以前用于为成人和儿童的胸腔引流管插入部位提供镇痛。为了支持这一点,Lukosiene等[28]证明了接受ICNB的儿科患者在放置胸腔引流管后的前6 h内吗啡消耗率降低。此外,肋间神经阻滞已被证明可以减少接受Nuss手术治疗漏斗胸患者的阿片类药物用量,因此,这些患者也降低了阿片类药物相关毒副作用的发生率[29]。
4.5 竖脊肌平面阻滞
竖脊肌平面阻滞(erector spinae plane block,ESPB)是一种新技术,由Forero于2016年首次在成人患者中描述[30]。在这个阻滞中,局部麻醉剂在超声引导下注射到T5节段处竖脊肌深处的筋膜平面。在大多数情况下,该阻滞在技术上易于实现,并且被认为比TEA和TPVB更安全,因为注射部位远离胸膜和椎管内结构。此外,越来越多的证据表明ESPB对成人胸外科手术后急性疼痛管理的有效性。尽管最近在两个病例报告中描述了放置导管和连续ESPB阻滞,然而在儿童中,那些接受开胸手术的7个月和15个月大的婴儿对于该阻滞的操作及有效性仍然鲜有文献报道[31-32]。
4.6 前锯肌平面阻滞
前锯肌平面阻滞(serratus anterior plane block,SAPB)是另一种新提出的筋膜阻滞,旨在为胸壁手术提供镇痛和/或麻醉[33]。在超声引导下在腋后线和腋中线之间注射局麻药,目的是阻断肋间臂神经、肋间神经外侧皮支(T3~T9)、胸长神经和前锯肌与背阔肌之间的胸背神经。SAPB通常用于乳房手术,但它在成人VATS手术后的疼痛管理中越来越受欢迎。最近,SAPB也被用在10岁接受VATS的患者中[34]。为进一步支持这一点,Kaushal等[35]最近比较了SAPB、胸神经II阻滞和ICNB在小儿心脏手术后开胸术后疼痛管理中的疗效,得出的结论是SAPB和胸神经II适合用于儿童,并可能进一步降低术后疼痛,定义为与研究中评估的其他两种区域技术相比,芬太尼消耗量减少。
4.7 阿片类药物
阿片类药物仍然是胸外科手术后,中度至重度疼痛管理的多模式方案的重要组成部分。它们通常与包括ICNB或TPVB在内的单次区域阻滞技术联合使用。静脉患者自控镇痛(patient-controlled analgesia,PCA)是在这些患者中管理术后阿片类药物的最常见和最有效的策略之一。在儿童中,由于认知成熟度问题,PCA泵的需求剂量管理通常保留给6岁以上的患者;在更年幼的孩子中,通常由护士或受过最低教育程度的父母充当代理人,帮助年幼的患者管理PCA。连续基础阿片类药物输注通常不建议用于初次使用镇痛泵的情况,但在疼痛缓解不足的情况下可以考虑[36]。在最近对儿童随机试验的荟萃分析中,伴或不伴背景输注的PCA中,在阿片类药物消耗、疼痛缓解或不良事件发生率方面,作者没有发现任何差异,证据质量较差,因为总样本量较小[37]。鉴于此,笔者建议不要初始使用背景阿片类药物输注。就适合通过PCA给药的阿片类药物而言,吗啡是在世界范围内PCA最常用的药物,哌替啶、芬太尼和氢吗啡酮也有使用。在初次使用阿片类药物的患者中,吗啡背景输注速度通常应设置为0.01~0.03 mg/kg/h。在婴儿和儿童中,吗啡的负荷剂量通常在0.05~0.1 mg/kg,PCA推注剂量为0.01~0.03 mcg/kg,锁定间隔为6~10 min[38]。氢吗啡酮也可以按计划或必要时给药,剂量为5~15 μg/kg静脉推注,间隔4~6 h。同样,一旦患者能够口服药物,可以每隔4~6 h口服羟考酮(0.1~0.2 mg/kg)或氢可酮(0.05~0.1 mg/kg)。曲马多代表了另一种管理中度疼痛和促进术后第2天从其他阿片类药物过渡的替代方法。常用剂量为每4~6 h 1~2 mg/kg(静脉或口服给药)。此外,它可以与局部区域技术结合使用来代替前面提到的阿片类药物之一。
4.8 NSAIDS和对乙酰氨基酚
无论临床医生是否决定结合区域阻滞技术,NSAIDS和对乙酰氨基酚都应该作为多模式镇痛策略的基础常规应用,因为它们的镇痛作用已被证明可以在许多不同手术的围术期减少阿片类药物的消耗。此外,没有可信的证据表明非甾体抗炎药,特别是酮咯酸会增加胸外科手术后出血的风险。酮咯酸通常以0.5~1 mg/kg的负荷剂量静脉推注给药,随后每6 h以0.15~0.2 mg/kg的剂量给药,最多2 d[15]。如果静脉途径不可用,酮咯酸也可以每4~6 h以0.2 mg/kg的剂量口服给药。理想情况下,对乙酰氨基酚在体重小于10 kg的儿童中应以7.5 mg/kg的剂量静脉输注15 min以上,体重超过10 kg的儿童,剂量为15 mg/kg,每6 h输注1次,直至术后第3天[15]。
4.9 NMDA拮抗剂、地塞米松和加巴喷丁类
NMDA受体拮抗剂,如氯胺酮和硫酸镁,可在术中使用,以减少术后即刻使用的阿片类药物量。氯胺酮的典型静脉内剂量为0.25~0.5 mg/kg,最高可达20 mg。地塞米松也可以以0.15 mg/kg的剂量用于止吐和镇痛。对于加巴喷丁类药物,如加巴喷丁和普瑞巴林等,几乎没有已发表的文章来指导临床医生将其用作儿童多模式镇痛策略的一部分,尽管它们的使用可能代表了一种新的、有效的替代方法,可进一步补充多模式镇痛方法用于较大的孩子。
5 结论
单肺通气的所有方法各有利弊,需要一定程度的实践和技术掌握才能安全有效地实施。在决定技术或设备时,临床医生应注意权衡任何一种方法对特定患者进行肺通气的风险和收益。这也适用于局部区域技术的选择,但最终取决于手术方法和临床医生对给定区域技术的熟悉程度。事实上,一些新的筋膜阻滞如ESB和SAPB可能比椎管内入路更安全,但需要更多的经验来评估这些技术在该情况下的真实疗效。最后,应采用多模式方法,包括非甾体抗炎药、对乙酰氨基酚,必要时加用阿片类药物,以确保胸部手术后儿童的疼痛得到充分缓解。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Paolo Scanagatta) for the series “Pediatric Thoracic Surgery” published in Pediatric Medicine. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at https://pm.amegroups.com/article/view/10.21037/pm.2019.06.02/coif). The series "Pediatric Thoracic Surgery" was commissioned by the editorial office without any funding or sponsorship. The authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Hammer GB. Single-lung ventilation in infants and children. Paediatr Anaesth 2004;14:98-102. [Crossref] [PubMed]
- Stephenson LL, Seefelder C. Routine extraluminal use of the 5F Arndt endobronchial blocker for one-lung ventilation in children up to 24 months of age. J Cardiothorac Vasc Anesth 2011;25:683-6. [Crossref] [PubMed]
- Templeton TW, Downard MG, Simpson CR, et al. Bending the rules: a novel approach to placement and retrospective experience with the 5 French Arndt endobronchial blocker in children <2 years. Paediatr Anaesth 2016;26:512-20. [Crossref] [PubMed]
- Marciniak B, Fayoux P, Hebrard A, et al. Fluoroscopic guidance of Arndt endobronchial blocker placement for single lung ventilation in small children. Acta Anaesthesiol Scand 2008;52:1003-5. [Crossref] [PubMed]
- Templeton TW, Lawrence AE, Lee AJ, et al. Inside out: reurposing endobronchial intubation to facilitate extraluminal placement of a 5 Fr Arndt bronchial blocker in young infants. Paediatr Anaesth 2018;28:668-9. [Crossref] [PubMed]
- Bird GT, Hall M, Nel L, et al. Effectiveness of Arndt endobronchial blockers in pediatric scoliosis surgery: a case series. Paediatr Anaesth 2007;17:289-94. [Crossref] [PubMed]
- Haynes SR, Bonner S. Anesthesia for thoracic surgery in children. Paediatr Anaesth 2000;10:237-51. [Crossref] [PubMed]
- Dunn PF. Physiology of the lateral decubitus position and one-lung ventilation. Int Anesthesiol Clin 2000;38:25-53. [Crossref] [PubMed]
- Kubota H, Kubota Y, Toyoda Y, et al. Selective blind endobronchial intubation in children and adults. Anesthesiology 1987;67:587-9. [Crossref] [PubMed]
- Piccioni F, Vecchi I, Spinelli E, et al. Extraluminal EZ-blocker placement for one-lung ventilation in pediatric thoracic surgery. J Cardiothorac Vasc Anesth 2015;29:e71-3. [Crossref] [PubMed]
- Templeton TW, Templeton LB, Lawrence AE, et al. An initial experience with an extraluminal EZ-Blocker: a new alternatice for one-lung ventilation in pediatric patients. Paediatr Anaesth 2018;28:347-51. [Crossref] [PubMed]
- Hammer GB, Brodsky JB, Redepath JH, et al. Use of the Univent tube for single-lung ventilation in paediatric patients. Paediatr Anaesth 1998;8:55-7. [Crossref] [PubMed]
- Seefelder C. Use of the 26-French double-lumen tube for lung isolation in children J Cardiothorac Vasc Anesth 2014;28:e19-21. [Crossref] [PubMed]
- Merkel SI, Voepel-Lewis T, Shayevitz JR, et al. The FLACC: A behavioral scale for scoring postoperative pain in young children. Pediatr Nurs 1997;23:293-7. [PubMed]
- Vittinghoff M, Lonnqvist PA, Mossetti V, et al. Postoperative pain management in children: Guidance from the pain committee of the European Society for Paediatric Anaesthesiology (ESPA Pain Management Ladder Initiative). Paediatr Anaesth 2018;28:493-506. [Crossref] [PubMed]
- Shah RD, Suresh S. Applications of regional anaesthesia in paediatrics. Br J Anaesth 2013;111:i114-24. [Crossref] [PubMed]
- Ivani G, Suresh S, Ecoffey C, et al. The European Society of Regional Anaesthesia and Pain Therapy and the American Society of Regional Anesthesia and Pain Medicine Joint Committee Practice Advisory on Controversial Topics in Pediatric Regional Anesthesia. Reg Anesth Pain Med 2015;40:526-32. [Crossref] [PubMed]
- Kendall MC, Castro Alves LJ, Suh EI, et al. Regional anesthesia to ameliorate postoperative analgesia outcomes in pediatric surgical patients: an updated systematic review of randomized controlled trials Local and Regional. Anesthesia 2018;11:91-109. [Crossref] [PubMed]
- Walker BJ, Long JB, Sathyamoorthy M, et al. Complications in Pediatric Regional Anesthesia. An Analysis of More than 100,000 Blocks from the Pediatric Regional Anesthesia Network. Anesthesiology 2018;129:721-32. [Crossref] [PubMed]
- Berde CB, Boretsky KR, Cravero JP. Paravertebral block for analgesia after pediatric thoracic surgery. Reg Anesth Pain Med 2014;39:179-80. [Crossref] [PubMed]
- Tsui BCH, Suresh S. Ultrasound Imaging for Regional Anesthesia in Infants, Children, and Adolescents A Review of Current Literature and Its Application in the Practice of Neuraxial Blocks. Anesthesiology 2010;112:719-28. [Crossref] [PubMed]
- Vecchione TM, Boretsky KR. Ultrasound Images of the Epidural Space through the Acoustic Window of the Infant. Anesthesiology 2017;126:126:562.
- Visoiu M. Paediatric regional anaesthesia: a current perspective. Curr Opin Anaesthesiol 2015;28:577-82. [Crossref] [PubMed]
- Boretsky K, Visoiu M, Bigeleisen P. Ultrasound-guided approach to the paravertebral space for catheter insertion in infants and children. Paediatr Anaesth 2013;23:1193-8. [PubMed]
- Vecchione T, Zurakowski D, Boretsky KR. Thoracic Paravertebral Nerve Blocks in Pediatric Patients: Safety and Clinical Experience. Anesth Analg 2016;123:1588-90. [Crossref] [PubMed]
- Hall Burton DM, Boretsky KR. A comparison of paravertebral nerve block catheters and thoracic epidural catheters for postoperative analgesia following the Nuss procedure for pectus excavatum repair. Paediatr Anaesth 2014;24:516-20. [Crossref] [PubMed]
- Qi J, Du B, Gurnaney H, et al. A prospective randomized observer-blinded study to assess postoperative analgesia provided by an ultrasound-guided bilateral thoracic paravertebral block for children undergoing the Nuss procedure. Reg Anesth Pain Med 2014;39:208-13. [Crossref] [PubMed]
- Lukosiene L, Macas A, Trepenaitis D, et al. Single shot intercostal block for pain management in pediatric patients undergoing the Nuss procedure: a double-blind, randomized, controlled study. J Pediatr Surg 2014;49:1753-7. [Crossref] [PubMed]
- Luo M, Liu X, Ning L, et al. Comparison of Ultrasonography-guided Bilateral Intercostal Nerve Blocks and Conventional Patient-controlled Intravenous Analgesia for Pain Control After the Nuss Procedure in Children A Prospective Randomized Study. Clin J Pain 2017;33:604-10. [Crossref] [PubMed]
- Forero M, Adhikary SD. The Erector Spinae Plane Block A Novel Analgesic Technique in Thoracic Neuropathic Pain. Reg Anesth Pain Med 2016;41:621-7. [Crossref] [PubMed]
- Kaplan I, Jiao Y, AuBuchon JD, et al. Continuous Erector Spinae Plane Catheter for Analgesia After Infant Thoracotomy: A Case Report. A&A Practice. 2018;11:250-2. [Crossref] [PubMed]
- Gaio-Lima C, Costa CC, Moreira JB, et al. Continuous erector spinae plane block for analgesia in pediatric thoracic surgery: A case report. Rev Esp Anestesiol Reanim. 2018;65:287-90. [Crossref] [PubMed]
- Blanco R, Parras T, McDonnell JG, et al. Serratus plane block: a novel ultrasound-guided thoracic wall nerve block. Anaesthesia 2013;68:1107-13. [Crossref] [PubMed]
- Corso RM, Piraccini E, Byrne H, et al. The serratus anterior plane block for pediatric non-intubated video-assisted thoracoscopic surgery. Minerva Anestesiol 2017;83:775-6. [PubMed]
- Kaushal B, Chauhan S, Saini K, et al. Comparison of the Efficacy of Ultrasound-Guided Serratus Anterior Plane Block, Pectoral Nerves II Block, and Intercostal Nerve Block for the Management of Postoperative Thoracotomy Pain After Pediatric Cardiac Surgery. J Cardiothorac Vasc Anesth 2019;33:418-25. [Crossref] [PubMed]
- Grass JA. Patient-Controlled Analgesia. Anesth Analg 2005;101:S44-61. [Crossref] [PubMed]
- Hayes J, Dowling JJ, Peliowski A, et al. Patient-Controlled Analgesia Plus Background Opioid Infusion for Postoperative Pain in Children: A Systematic Review and Meta-Analysis of Randomized Trials. Anesth Analg 2016;123:991-1003. [Crossref] [PubMed]
- Yaster M, Andresini J, Krane EJ. Epidural analgesia. In: Yaster M, Krane EJ, Kaplan RF, et al. editors. Pediatric Pain Management and Sedation Handbook. St. Louis, Mosby, 1997:113-47.
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Piccioni F, Templeton TW, Morris B, Valenza F. Pediatric thoracic anesthesia: airway management for lung isolation and postoperative analgesia. Pediatr Med 2019;2:23.







