
支气管性疾病:硬性气管镜的诊断和治疗
1897年,Gustav Killian通过使用直径为9 mm的管道最先成功完成支气管镜手术操作[1]。1902年,Eihorn在管子的远端增加照明系统,使得手术操作变得更加简单、安全。而来自美国宾西尼亚的匹斯堡的支气管镜师——Chevalier Jackson又为支气管镜的发展带来新的技术。在1907年,他发表著作《气管镜,食管镜和支气管镜》[2],并在书中明显阐述他对支气管镜及其辅助器械的新设计和新规划。
从硬性支气管镜发明以来,人类对其重视的程度不断改变。一开始,硬性支气管镜检查就被医生作为中央气管检查的主要手段。而随着纤维支气管镜的发展,其临床地位逐渐被纤维支气管镜取代。到了20世纪80年代,医生们对硬性支气管镜兴趣复燃。而且随着肺癌的诊断率不断增加以及内镜治疗的出现,最终一门新生专业性科目——介入性呼吸病学诞生。
现今,硬性支气管镜已成为中央气道检查的主要手段,主要用于中央气道的难治性肺病和气道恶性肿瘤的诊治。硬性支气管镜可以有效的用于各种治疗,包括激光切除、气管支架置放术、球囊扩张、氩离子凝固术以及冷冻术。尽管初始的支气管镜构造十分简易,但今天所使用的支气管镜与Jackson所构想及使用的并没有明显差别。再者,由于麻醉医学和呼吸机的快速发展,内镜手术已被认为是一项简单而又安全的诊治手段。
1 适应证
如表1所示,硬性支气管镜可用于儿童呼吸系统的良恶性疾病的诊断和治疗[3]。硬性内窥镜检查是声门及声门下疾病诊断(裂口、高位瘘)和治疗(例如异物取出、支架置放、激光手术)的最好方式。如果患者必须进行手术治疗,硬性支气管镜检查同样可以为手术操作者提供高像素的气管结构照片[4]。同样支气管镜也可用于直接探测气管狭窄处的僵硬程度。对于严重型或非典型性的声门下异物阻塞疾病的排除,最好采用喉镜加超薄型显微镜并配合短效麻醉。该方法不会伤及患者的黏膜表层而加重阻塞[5]。在一些气道肿瘤和气管结核患者中,硬性支气管镜是进行经气道活检、气管瘘排查以及气管疏通治疗的必要手段。
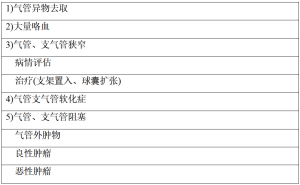
Full table
2 仪器设备
现今使用的仪器与19世纪50年代使用的仪器没有明显差别,但随着光学技术和辅助器械技术的改善,硬性支气管镜在手术部位中可高清晰呈像,并在手术过程中进行精细操作。
硬性支气管镜有不同的规格,小儿硬性支气管镜的长度通常为20~43 cm,直径范围为3.5~8.5 mm,具体操作以患者年龄为准(表2)。不同规格的管壁厚度为2~3 mm,管内径则一致。支气管镜的近端由一个中央开口和侧门组成,可以用于放入硬性显微镜以及辅助器械(例如钳子、吸引管、激光导光纤维、硅胶支架输送系统)。近端的侧孔主要用于连接患者的呼吸机和照明系统。镜远端是一斜面钝性开口,防止在经过患儿喉部时损伤声门,其次在经过严重狭窄部位时,可以“螺旋旋转”方式或者“挖空”梗阻部位以便经过。
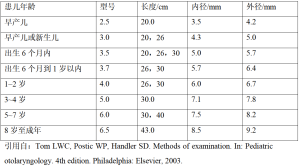
Full table
近年来,Dumon不仅对经典的支气管镜的结构进行改造,还发明了一个“通用管口”,可用于连接各种不同长度或宽度的支气管镜。这种新管口有专门用于吸引管、激光纤维管和显微镜的孔道。
硬性支气管镜的照明系统是由氙气提供光源。硬性支气管的光学显微镜在对气道进行呈像的过程中可将视野进行轻微放大。同样的在进行硬性支气管镜检查的时候,主要采用无角度偏移的显微镜进行诊治,但角度偏移30°或40°左右则可以更好地看清楚上肺叶的小支气管。专用摄像机可以直接连接到显微镜,并将图像传输到共享的监视屏,允许不同的操作团队一起工作;同样该过程可以记录在数字媒体上。
3 气管异物
气管异物的取出是硬性支气管镜的首次临床应用,至今仍是重要的手术指征。儿童吸入异物通常是偶然性发生的,又被称为“洞察综合征”,其临床主要表现为急性呼吸困难、窒息、剧烈咳嗽,有时可出现呕吐症状。但是事实上,异物吸入的诊断敏感性很高。在各种病例的报道中,该病的比例可达80%~97%。但该病的诊断特异性很低,临床数据显示急性窒息事件发生后患儿的临床表现是多变的,即使患儿没有发生异物吸入也会出现同样的临床症状[6-8]。在某些情况下,气道的完全性阻塞(喉咙或气管)会使患儿出现持续且剧烈的咳嗽。有时,持续性剧烈的咳嗽可使患儿咳出异物[9]。但当患儿不能将异物咳出时,则会快速出现致命性呼吸困难。这时患儿并不能进行任何的介入性治疗。在这种情况下,只有迅速、有效地执行海姆利克氏操作法才能拯救患儿的生命。这2种极端现象在患儿异物吸入后的任何时间段都可能发生,与患儿的年龄,异物的类型、大小以及异物在气管、支气管树中的部位有关。综上所述,对于具有异物吸入病史或是怀疑异物吸入的患儿,都必须及时进行支气管镜的诊断排除和介入性治疗。对于怀疑有异物吸入,但是临床症状和体征不显著时,可进行支气管镜检以便确诊或排除[7,10]。吸气和呼气时的胸部X线片显像提示胸腔空气潴留的患儿,可进行支气管镜检查以便异物的诊查。
4 咯血
少量咯血的患者可进行纤维支气管镜检疗,而大量咯血则必须进行硬性支气管镜的诊治。对于伴有咯血,且胸片提示肺部有阴影增厚的,硬性支气管镜的检查可提示是否有异物、肿瘤或是血管畸形的存在。
5 气管、支气管狭窄
5.1 评估和治疗
气管和支气管狭窄可能是由于创伤、某些感染性疾病、不同部位的肿瘤或是其他病因所导致,如由继发性喉-气管狭窄(secondary laryngo-tracheal stenosis,SLS)的并发症导致的。在婴儿出生后第1年中,严重的喉气管损伤是导致气管、支气管狭窄的最常见原因,发病率为0.9%~8.3%。90%的SLS是由于气管插管损伤、非专家实施的难治性气管插管、急性阻塞性的气道感染的气管插管或是插管后高危患者气道的反复感染所致。内镜诊查评估包括气管的狭窄部位、狭窄的程度以及Cotton-Myer分级的级别[11]。
在气管狭窄的若干治疗方案中,气管扩张的成效最显著,并可为后续更有效的治疗提供时间基础。内镜探条型号可从6F到20F进行选择。在气管镜的直观下渐进性地将探条穿过狭窄部位,但是最大型号的尺寸受到扩张型支气管镜的内径的限制。另一种技术就是直接通过支气管镜的宽度扩张狭窄部位。根据支气管镜的大小,由小到大,逐渐扩张狭窄部位。要注意的是,在扩张的过程中,必须避免过度暴力。在很多条件下,弛缓性狭窄可采用球囊进行扩张。同样,有文献报道在瘢痕性声门下狭窄的激光去顶治疗中,可以先采用球囊扩张进行初始治疗。对于大部分的超表面或是较浅的组织可通过激光耦合方式取出,这样可以避免损害喉部以及气管软骨膜,避免产生继发性狭窄。激光也可用于去除肉芽组织(例如气管切开术后的脱管前手术部位新生的肉芽组织)或者感染性肿物(例如非结核性分枝杆菌的肉芽肿[12])以及气管的瘢痕性梗阻性伤口[13]。
5.2 气管支架
在成人的肿瘤性气道狭窄治疗中,气管支架的使用已成为常规治疗手段。近期在一系列儿童的气管成型术后也提议气管支架的使用[14-15]。同样的,对于气管-支气管软化症或是气管梗阻性恶性肿瘤性疾病的患儿已被证实临时性气管支架可成功缓解患儿症状[16],但支架长期使用的安全性仍存在严重问题,特别是移除支架后气管外部血管对气管产生的压迫[17]。技术的改进和更好的材料使它们比其他干预措施更具有吸引力[18],例如食管闭锁修复后发生顽固性气道症状的儿童或是心脏术后的一些特定病例的主动脉固定术[19]。
气管-支气管支架可简单分为两类:一类为硅胶性支架,一类为金属性支架。前者对气管的黏膜有较好的相容性,可被长时间放置且容易移除[20-21]。而他们最主要的问题是在于:如果型号大小不匹配,在气管中容易发生移位[22],而且会干扰局部的黏液纤毛的清除效率。相反,金属支架在气管中很容易被上皮化,维持更好的黏液纤毛的清除功能,不容易发生移位,但这同时也使得他们很难被移除。而且随着时间的推移,金属支架可自行校准——这一特性使它们能够适应因生长而引起的气道变化。
5.2.1 球囊扩张式支架
球囊扩张式支架由不锈钢网筛构成,具有不同长度和直径。通过硬性支气管镜的内镜控制和放射性成像进行支架的定位,而后通过血管成形术的球囊将支架放置在气管狭窄部位或气管软化部位[23-24]。一旦确定了球囊的确切位置,就可以通过放射性成像来控制球囊的充盈,然后通过内窥镜进一步观察球囊充盈情况。
使用该类型支架的优点在于:容易插入气管;可以定位于小支气管,并可根据儿童的生长发育情况调整支架的直径。缺点在于肉芽组织的形成以及支架一旦置入,则难以取出。
5.2.2 自身扩张型金属支架
自身扩张型金属支架具有恢复性,即在气管中受到压迫,也可恢复到原来的形态[25]。他们自身扩张的特性使得其直径可在8~20 mm中进行自身调节。同样自身的灵活性使得他们可以适用于复杂的气管狭窄类型,不易发生移位,并且在完全发生上皮化之前可以移除该支架。然而,他们所能承受的径向压力较小,故不能用于一些更紧密的瘢痕性狭窄。
5.2.3 硅胶性支架
硅胶性支架易于安置也很容易取出,但也存在某些不足。如果支架的型号与气管不匹配,将会导致肉芽组织形成,最终可能需要进行气管镜治疗。为减少支架发生移位的风险,根据患儿的年龄,所采用的支架直径应比理论气管直径长4 mm。随着患儿年龄的增长,硅胶支架的长度并不会随着气管而发生变化,在一定时间段后,需要取出支架并重新放置硅胶性支架。在以下2种情况,不可进行气管的硅胶性支架置入:1)没有足够的设备指导硅胶性支架置入于儿童气管中;2)硅胶性支架不含孔道或没有持续的方法可使置入支架处为气管提供充足的通气。
Fogarty以及血管成形术的球囊可协助支架的准确定位。
支气管支架的使用在儿科疾病治疗中是一个不断进步的过程。进行气管支架置入的患儿常见的特征即无法用常规的方式撤除呼吸机或是由于自身状态较差,无法进行手术治疗的气管、支气管硬化。理想的气管支架应该具备以下特征[26-27]:1)容易置入;2)并发症较少;3)容易甚至不需移除;4)具有不同型号;5)置入后不会发生迁移;6)具有一定的耐压性;7)具有能够适应气道结构的弹性;8)产品的材料具有生物惰性(不刺激气道,不会引起肉芽组织生成);9)不影响气道黏膜纤毛的功能。但目前还没有一种装置可以完全满足这些理想特性并能够结合硅胶和金属支架的优点。
6 气管软化症
气管软化症(tracheobronchomalacia,TM)或称为气管运动障碍,是指先天性或后天性的气管壁软化导致呼吸时管壁塌陷。分为部分性软化(50%<气道梗阻<80%),严重性软化(气道梗阻>90%)。
原发性TM是指儿童时期气管的散发性畸形所致,继发性TM则是由于临近组织的压迫过程导致[28]。气管软化部位仅发生于一小段支气管,称为节段性TM;软化发生于大部分气管甚至于全长则称为广泛性TM。
内镜下可观察到TM患者的气管呈松弛状,气管环轮廓不清晰,胸廓内的气管在呼气的时候内陷,明显的时候可以观察到部分部位凸起,甚至可达到气管隆突处。
患支气管软化症的儿童,特别是2岁以内的患儿,在后期由于气管的发育自身可逐渐恢复。小部分患儿可经受外科手术治疗。因此,关于TM的治疗可以分为两类:1)对于2岁以内的TM患者,由于TM症状可随着患儿的生长发育而缓解,建议进行内科保守治疗(例如:药物治疗、物理运动治疗),不建议进行气管内镜治疗;2)需要进行外科手术治疗(由于血管环导致的继发性TM,严重的继发于气管造口术或气管食管瘘)。
7 讨论
上气道的异物吸入性梗阻是导致儿童发病和死亡的常见原因。正如Jackson在他第1篇硬支气管镜检查的著作中所说:“对于疑似气道异物吸入的患儿,必须对其进行支气管镜检查,因为不进行支气管镜检查的风险比进行支气管镜检查所伴有的并发症更危险”。尽管患儿异物吸入性窒息的病死率不是很高,但是由耳鼻喉科医生、儿科医生和放射科医生组成的多学科团队对于该疾病的诊治至关重要。配备完整的儿科支气管镜器械及各种类型的钳子和辅助设施对于异物的移除也很重要。在配备完善的设备的同时安排具有丰富经验的操作者和安全的麻醉剂量,就算是在紧急的手术操作状况下,同样可以使患儿处于安全、舒适的环境。合格的麻醉师可协助手术操作者的操作。在治疗过程中,两位医师相互协作进行硬性支气管镜检查。经验丰富的麻醉师可使支气管镜的操作过程更安全,使得操作者具有充足的时间进行诊断与治疗。
综上所述,硬性支气管镜具有许多优点。无论是由良性狭窄、肿瘤还是吸入的引物所引起的气道梗阻,该操作均是进行气道操作的最佳方式。显微镜的使用可放大观察部位,更加清晰地观察气道内结构。与纤支镜相比,通过硬性支气管镜进行介入手术更加节省时间。与之相关,硬性支气管镜的操作是在患儿全身麻醉的状态下实施的,此时患儿无法进行活动,全身肌肉处于放松状态下,咳嗽反应被抑制,故可进行更长久、更复杂的手术。
硬性支气管镜操作的简便性使得其治疗过程中应用得更加广泛,比如气管内激光治疗、电烙术、冷冻疗法和气管内支架定位的操作都可通过硬性支气管镜完成,特别是硅胶性支架,只能采用硬性支气管镜进行安置。同样,支气管镜也可为抓住气道异物的钳子或是气道出血部位的挤压包提供通道。
如今,儿童支气管镜的实用性已被临床医生认可,且相比于成人支气管镜,其存在自身的独特型和特异性。临床上,儿童支气管镜用于诊断和治疗的频率越来越高。在未来的一些前瞻性研究中,应该在支气管镜对患者的疗效和益处部分进行进一步的分析和验证,以及对技术改进的持续关注。在一些科学领域,支气管镜也日益成为一种用于更好地理解病理生理学概念,以及评估局部治疗的应用效果的研究工具。同时,临床工作者永远不应该忘记前辈流传下来的经验性建议,即“只有当我们希望获得的信息或预期的疗效远大于操作所带来的潜在风险时,才应该进行支气管镜检查”。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Paolo Scanagatta) for the series “Pediatric Thoracic Surgery” published in Pediatric Medicine. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at https://pm.amegroups.com/article/view/10.21037/pm.2019.07.04/coif). The series “Pediatric Thoracic Surgery” was commissioned by the editorial office without any funding or sponsorship. The authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Prakash UBS, Diaz-Jimanez JP. The rigid bronchoscope. In: Prakash UBS. Editor. Bronchoscopy. New York: Raven Press, 1994:53-69.
- Jackson C. The life of Chevalier Jackson: An autobiography. New York: MacMillan, 1938.
- Sen MK, Suri JC. Therapeutic bronchoscopy. Indian J Chest Dis Allied Sci 2000;42:167-79. [PubMed]
- Handler SD. Direct laryngoscopy in children: rigid and flexible fiberoptic. Ear Nose Throat J 1995;74:100-4, 106. [Crossref] [PubMed]
- Nicolai T. Endoscopy of the respiratory tract in childhood. Fortschr Med 1996;114:322-6. [PubMed]
- Martinot A, Deschildre A, Brichet A, et al. Indications of bronchial endoscopy in suspected tracheo-bronchial foreign body in children. Rev Mal Respir 1999;16:673-8. [PubMed]
- Hoeve LJ, Rombout J, Pot DJ. Foreign body aspiration in children.The diagnostic value of signs, symptoms and pre-operative examination. Clin Otolaryngol 1993;18:55-7. [Crossref] [PubMed]
- Barrios Fontoba JE, Gutierrez C, Lluna J, et al. Bronchial foreign body: should bronchoscopy be performed in all patients with a choking crisis? Pediatr Surg Int 1997;12:118-20. [Crossref] [PubMed]
- Black RE, Johnson DG, Matlak ME. Bronchoscopic removal of aspirated foreign bodies in children. J Pediatr Surg 1994;29:682-4. [Crossref] [PubMed]
- Svensson G. Foreign bodies in the tracheobronchial tree. Special references to experience in 97 children. Int J Pediatr Otorhinolaryngol 1985;8:243-51. [Crossref] [PubMed]
- Myer CM 3rd, O'Connor DM, Cotton RT. Proposed grading system for subglottic stenosis based on endotracheal tube sizes. Ann Otol Rhinol Laryngol 1994;103:319-23. [Crossref] [PubMed]
- Piedimonte G, Wolford ET, Fordham LA, et al. Mediastinal lymphadenopathy caused by Mycobacterium avium-intracellulare complex in a child with normal immunity: successful treatment with anti-mycobacterial drugs and laser bronchoscopy. Pediatr Pulmonol 1997;24:287-91. [Crossref] [PubMed]
- Wagner I, Ayache D, Denoyelle F, et al. Treatment by CO2 broncho-laser for acquired tracheobronchial stenosis in children with bronchopulmonary dysplasia. Arch Pediatr 1996;3:1079-83. [Crossref] [PubMed]
- Filler RM, Forte V, Fraga JC, et al. The use of expandable metallic airway stents for tracheobronchial obstruction in children. J Pediatr Surg 1995;30:1050-5; discussion 1055-6. [Crossref] [PubMed]
- Filler RM, Forte V, Chait P. Tracheobronchial stenting for the treatment of airway obstruction. J Pediatr Surg 1998;33:304-11. [Crossref] [PubMed]
- Nicolai T, Huber RM, Pfeifer KJ, et al. Bilateral bronchial balloon dilatation and Strecker stent implantation in a ventilated child with malignant carinal stenosis. Intensive Care Med 1996;22:482-5. [Crossref] [PubMed]
- Cook CH, Bhattacharyya N, King DR. Aortobronchial fistula after expandable metal stent insertion for pediatric bronchomalacia. J Pediatr Surg 1998;33:1306-8. [Crossref] [PubMed]
- Tsugawa C, Nishijima E, Muraji T, et al. A shape memory airway stent for tracheobronchomalacia in children: an experimental and clinical study. J Pediatr Surg 1997;32:50-3. [Crossref] [PubMed]
- Subramanian V, Anstead M, Cottrill CM, et al. Tetralogy of Fallot with absent pulmonary valve and bronchial compression: treatment with endobronchial stents. Pediatr Cardiol 1997;18:237-9. [Crossref] [PubMed]
- Froehlich P, Truy E, Stamm D, et al. Role of long-term stenting in treatment of pediatric subglottic stenosis. Int J Pediatr Otorhinolaryngol 1993;27:273-80. [Crossref] [PubMed]
- Schuller DE. Long-term stenting for laryngotracheal stenosis. Ann Otol Rhinol Laryngol 1980;89:515-20. [Crossref] [PubMed]
- Lim LH, Cotton RT, Azizkhan RG, et al. Complications of metallic stent in the pediatric airway. Otolaryngol Head Neck Surg 2004;131:355-61. [Crossref] [PubMed]
- Ruegemer JL, Perkins JA, Azarow KS, et al. Effect of the Palmaz balloon-expandable metallic stent in the trachea of pigs. Otolaryngol Head Neck Surg 1999;121:92-7. [Crossref] [PubMed]
- Park AH, MacDonald R, Forte V, et al. A novel approach to tracheostomal collapse: the use of an endoluminal Palmaz stent. Int J Pediatr Otorhinolaryngol 1998;46:215-9. [Crossref] [PubMed]
- Dasgupta A, Dolmatch BL, Abi-Saleh WJ, et al. Self-expandable metallic airway stent insertion employing flexible bronchoscopy: preliminary outcome. Chest 1998;114:106-9. [Crossref] [PubMed]
- Rafanan AL, Mehta AC. Stenting of the tracheobronchial tree. Radiol Clin North Am 2000;38:395-408. [Crossref] [PubMed]
- Saito Y. Endobronchial stents: past, present, and future. Semin Respir Crit Care Med 2004;25:375-80. [Crossref] [PubMed]
- Greenholz SK, Karrer FM, Lilly JR. Contemporary surgery of tracheomalacia. J Pediatr Surg 1986;21:511-4. [Crossref] [PubMed]
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Gonfiotti A, Droghetti A, Voltolini L, Muriana G, Divisi D, Crisci R, Viggiano D. Tracheal diseases: endoscopic evaluation and treatment . Pediatr Med 2019;2:38.


