
营养对危重症患儿临床结局的影响
据报道,0.15%~1.5%的患儿需要进入儿科重症监护室治疗[1-2],其中大部分患儿(41.4%)小于1岁[2]。危重症儿童的病死率在北美和欧洲是3%~5%[3],伴有感染性休克的患儿病死率增至10%[4],尤其在南非等中等收入国家,其病死率可高达27%[5]。近年来,对危重疾病的关注重点已转向改善临床预后和提高生存率[6],更多研究致力于设计干预措施来改善儿科重症监护病房(pediatric intensive care unit,PICU)后的存活率,营养是其中一个重要的组成部分。
1 营养不良与临床结局
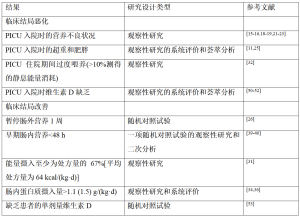
营养不良与住院时间增加有关[7-9]。由于所使用的营养不良的定义不同,各报道中PICU入院时营养不良的患病率有较大差异。多中心研究观察到的患病率为18%~25%[10-12],但单中心研究中可能超过50%[13-14]。在PICU住院期间,儿童的营养状况也可能发生改变。Valla等[15]报道24%的儿童在入院时有营养不良或因进入PICU而发育迟缓。此外,患有先天性心脏病等慢性疾病的儿童,可能有更高的持续性营养不良发生率,且身高与年龄之比<−2z分数[16]。研究表明:不理想的营养状态对肌力有显著影响[17],免疫改变可导致伤口愈合减缓、脓毒症发生率增加[18]、机械通气天数增加[19],术后弹性较差[18]、PICU住院时间更长[20],尤其对于术后儿童[15-16,19,21-22],可导致较差的临床预后[23]。最近的一项研究[23]表明:PICU入院时有营养不良是60 d病死率的预测因素,且PICU住院时间更长。在PICU出院6个月后,所有儿童的体重和身高均显示营养恢复[24]。
关于超重和肥胖,仍然缺乏危重儿童的数据。一项包括来自16个国家的90个PICU(60%来自美国和加拿大的PICU儿童)的多中心研究结果[11]显示:接受PICU治疗的儿童中有15%超重,13%肥胖。最近,一项系统的综述[25]分析了肥胖和危重症儿童临床预后之间的关系,结果显示:与非肥胖组相比,患有肥胖症的危重症儿童病死率更高、住院时间更长。肥胖在预测这一人群临床预后中的作用和潜在机制尚不清楚。
这些不同研究的结果表明了PICU入院时营养状况评估的重要性,以及需要一种有效的营养状况筛查工具来识别有临床预后不良风险的患者。此外,在病情危重时确保最佳的营养支持方案,以防止营养状况进一步下降,被视为改善这一弱势患者群体短期及长期临床结局的关键。
2 营养摄入与临床结局
尽管PICU入院期间的营养支持很重要,但宏量、微量营养素的类型和数量方面的需求仍不明确。PEPaNIC研究是一项大型前瞻性(短期和长期)预后研究[26],比较入院第1周分别使用早期与晚期肠外营养(parenteral nutrition,PN)支持,在随访2年和4年后的报道显示:保留PN 1周与病死率增加无关,且对人体测量、总体健康状况、认知和情绪发展没有负面影响[27-29]。有趣的是,抑制PN与改善抑制控制有关。26 d到11个月大的婴儿与早期使用PN相关的发育损害风险最大。因此,在这个年龄组中减少早期PN可能有利于改善长期发育结果[30]。其相关机制可能为白细胞端粒缩短,这是在接受早期PN的儿童中独立发现的[31],并且可能是早期给药氨基酸而非葡萄糖相关的DNA甲基化变化的结果[32]。这些发现需要进一步的研究,特别是其中的因果关系和早期营养支持相较于晚期营养支持可能对长期临床结局产生的影响。
2.1 能量摄入与临床结局
一些观察性研究调查了能量摄入和临床结局之间的关系。一项包括31个PICU的多中心观察性研究[21]表明:至少67%的处方能量摄入[平均处方为64 kcal/(kg·d)]与60 d病死率的显著降低相关。然而,能量消耗不是用间接测热法测量的,而是用各种方法估计的。最近,Larsen等[33]完成了一项为期5年的回顾性研究,他们使用间接测热法测量危重症儿童静息能量消耗以及营养过盛和营养不良与临床结局的关系,结果表明:只有12%的危重儿童得到了适当的喂养(定义为能量摄入±静息能量消耗的10%),53%的儿童喂养过度,35%的儿童喂养不足。与适当喂食的儿童相比,喂食过量的儿童住院时间和PICU治疗时间明显更长,而喂食不足的儿童住院时间和PICU治疗时间最短。作者强调,研究所描述的内容并不能推断因果关系,然而,当考虑到PEPaNIC研究的结果时,提示在危重症急性期的早期过度喂养可能是有害的。然而,长期的营养摄入不足可能对儿童有害。他们的结论是,这一领域的研究还相对较新,需要进行前瞻性研究来进一步研究这些关系。
2.2 蛋白质摄入与临床结局
在PEPaNIC研究中,氨基酸摄入量超过年龄参考营养素摄入量与病死率显著增加相关。氨基酸含量每增加10%,就增加一种新感染的风险,PICU存活的可能性随之降低。相比之下,前72 h内血糖升高与少数感染独立相关,血脂与更早出院独立相关[34]。PEPaNIC研究对随机分配到晚期PN组的儿童神经认知结果改善的机制提出了重要的猜想,据推测,在重症急性期,由于营养支持超过需求(特别是肠外氨基酸)[26-27,32,35],而抑制自噬可能是有害的[35]。目前尚不清楚摄入超过参考量的肠内营养(enteral nutrition,EN)是否有同样的效果。
与这些发现形成对比的是,2017年发表的一项系统性综述[36]考察了描述总蛋白质摄入对危重儿童蛋白质平衡和临床结局影响的研究文献。该综述包括了18项研究[8项随机对照试验(randomised controlled trials,RCTs)],这些研究发现总蛋白质摄入量>1.1 g/(kg·d),特别是超过1.5 g/(kg·d),与改善临床结局相关,包括降低病死率与正蛋白平衡。大多数研究采用肠内途径进行蛋白质传递,这可能解释了与PEPaNIC研究结果的差异[26]。然而,尽管有18项研究被纳入系统综述,但只有5项研究被认为具有很完备的研究设计。所回顾的研究的主要局限性在于患者选择、样本量、RCTs和观察性研究中缺乏盲法、随访失败、样本量不具代表性[36]。
一项较早的系统综述[37]也发现:最低蛋白质摄入量1.5 g/(kg·d)和57 kcal/(kg·d)与危重儿童的正氮平衡有关,但没有确定对于临床结局的最佳剂量。Wong等[38]近期也报道了一项观察性研究,蛋白质摄入量>1.5 g/(kg·d)与急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)危重儿童病死率的降低显著相关。
3 喂养类型与临床结局
3.1 早期EN与临床结局
由于液体限制、喂养不耐受和手术导致的中断,对危重儿童的EN支持往往具有挑战性[21,39-40]。一项在8个国家的31个PICU中开展的大型多中心观察队列研究[21]考虑了营养实践和危重儿童临床预后的关系,结果表明:较高的肠内摄食量和改善60 d病死率之间呈正相关,而PN则相反,其与病死率升高相关。Mikhailov等[41]也报道了类似的关系,他们回顾5 105名患者的医疗记录后发现:1)接受早期EN<48 h的患儿比不接受的患儿病死率低,即使调整年龄、危险分层评分和倾向分数,结果亦是如此;2)PICU住院时间>96 h的儿童中,早期EN与较低的病死率显著相关。同样地,心肺衰竭-儿童胰岛素滴定RCT的二次分析显示:对于伴有高血糖的危重儿童,早期EN(PICU入院后48 h内)与较好临床结局独立相关。早期EN与较低的90 d住院病死率、较多的无PICU天数、较多的无呼吸机天数和较少的器官功能障碍相关。2个研究组在PICU前8 d的每日能量摄入量相似[中位数36 kcal/(kg·d)[42]。
3.2 持续或间歇EN与临床结局
EN给药方法的类型,无论是连续的还是间歇的,都很少被研究,而且这些研究的结果是矛盾的。因此,没有证据支持使用这2种方法中的任何一种来改善临床结局[43]。3项随机研究(其中2项由同一人进行)比较了持续EN和间歇EN对临床结局的影响[44-46]。第1个研究显示:持续EN组在7 d内达到热量目标的速度明显快于间歇EN组,摄入的热量也比间歇EN组多。然而,胃肠道并发症的发生率和住院时间没有显著差异[44]。此外,其他2项研究的结果显示:两组在热量摄入、住院时间和胃肠道并发症[45]以及胃残留物量、给予的营养量和研究持续时间方面没有显著差异[46]。相比之下,间歇组开始EN更快[46]。
4 营养液类型
4.1 EN聚合物配方或半元素配方与临床结局
到目前为止,没有研究比较聚合物配方和半元素配方的临床结局。欧洲指南[43]建议使用聚合物溶液作为EN的首选,除非有证实的禁忌证。
4.2 蛋白质及能量丰富或标准的肠内配方和临床结局
ESPNIC指南[43]建议:为有液体限制的危重儿童考虑蛋白质和能量密集的配方,以满足他们的营养需求。这类研究的数量很少,而且没有研究相同类型的浓缩溶液,因此不可能就其潜在益处和不良反应推荐其中一种。1项对心脏手术后儿童的随机研究[47]将接受高能量EN溶液的一组与接受标准EN的一组进行了比较,结果显示:干预组体重明显减轻,能量摄入增加;相比之下,干预组患儿胃肠道不耐受发生率较高。然而,作者的结论为这些疾病可能与药物或营养以外的原因有关。有回顾性研究[48-49]记录了长期PICU住院儿童体重增长和胃肠道症状,这些儿童服用富含蛋白质和能量的配方,结果表明使用富含蛋白质的配方时体重有所改善,并且耐受性良好。一项随机研究[50]调查了蛋白质富集溶液与标准溶液的影响,结果显示:富蛋白饮食组血液蛋白质水平较高,热量和蛋白质摄入量及蛋白质平衡均较高,但不显著,没有出现不良反应或高蛋白血症。
5 药物营养与临床结局
药物营养的定义为使用高于推荐膳食摄入量的特定营养素,以影响免疫和临床结局。人们对这一领域的兴趣越来越大,但关于危重儿童的数据仍然稀缺。营养指南[43,51]认为,没有足够的证据建议在这一人群中使用药物营养(谷氨酰胺、脂类和/或微量营养素)。
危重症儿童的维生素D缺乏程度通常较低[52-53]。近期,有研究[52-54]显示PICU入院时维生素D缺乏与更高的病死率相关,而也有研究[55-56]没有观察到这种关联,但其仍增加了败血症的风险。在这种情况下,补充维生素D是一个有趣的选择。最近对109名缺乏维生素D的危重儿童进行的一项随机对照试验发现,单剂量维生素D可以改善他们的25OHD水平,并降低感染性休克和败血症的发生率[55]。危重症儿童,特别是有缺乏维生素D风险的儿童,应确认维生素D浓度,并建议补充维生素D有益于危重症儿童。然而,需要大量随机对照试验来证实优化维生素D状态可以改善临床结果。
一些对危重儿童的研究评估了谷氨酰胺的影响,出现了相互矛盾的结果。有研究[57-59]显示:谷氨酰胺补充剂是通过肠内途径提供的。同时也有研究显示了对炎症调节的积极影响,但不影响临床结局[55,59],而且当使用蛋白酶抑制剂时,不能从其他营养物质的作用中区分出谷氨酰胺的作用。谷氨酰胺补充剂是通过肠外途径提供的[60-61]。一项包括这些试验结果的荟萃分析[43]显示:谷氨酰胺对新感染的发生率和病死率没有显著影响。
含药物营养成分的肠内营养可调节免疫反应,但在危重儿童中未观察到对临床结局的影响。一项随机对照试验评估了补锌对危重婴儿的影响,发现在肺损伤评分、住院时间和机械通气时间方面没有差异[62]。一项小型随机对照试验[58]将含有精氨酸、谷氨酰胺、欧米茄3脂肪酸和抗氧化剂(维生素C、硒和锌)的肠内营养配方与标准肠内营养配方进行了比较,二者在炎症介质、继发感染、机械通气时间、住院时间或病死率方面没有观察到差异。目前缺乏关于危重儿童微量营养素补充的数据,需要设计良好的随机对照试验,来确定危重儿童在不同疾病阶段的微量营养素需求和补充的作用[63]。
关于PICU期间最佳能量和蛋白质摄入量及增加量的文献资料不足。虽然有关于危重疾病期间营养摄入的指南和建议,但由于缺乏高质量的证据,许多指南和建议都提供了专家共识[43,51]。迫切需要进一步研究以更好地了解短期和长期结局以及营养支持模式,例如宏量和微量营养素需求、EN与PN、宏量营养素的类型(例如全蛋白与肽、益生元纤维和脂肪酸来源)以及对身体成分和神经认知等功能结果的影响[43]。微量营养素状况也可能是危重疾病期间的一个重要考虑因素,未来的研究需要考虑短期补充对长期结局的影响,特别是康复方面[63]。
6 出院时的功能结果
很少有研究考虑儿童危重疾病对身体成分和获得性功能障碍的影响。Lee等[6]探究了描述儿童基线时的身体习惯与功能恢复之间的关系,结果显示:与成人研究一样,入院时较高的体重指数可能与较好的恢复有关,这可能是由于基线时较高的骨骼肌质量。PICU后功能障碍越来越被注意到,尽管其机制和病理生理学仍不清楚。Ong等[64]发现:37%~51%的儿童在PICU出院时出现新的暂时性功能障碍,另有7%~12%的患者出现持续性功能障碍。与成人报道相比,基线时(如入院时)体重指数高的儿童在出院时更有可能出现持续性获得性损伤。使用计算机断层扫描的身体成分分析描述了2种表型:1)高骨骼肌质量;2)高内脏脂肪质量。即使在调整了混杂因素后,高内脏脂肪仍与持续获得性损伤的风险增加有关。有趣的是,骨骼肌基线质量较大的儿童也与获得性损伤独立相关,尽管由于样本量较小,这些发现之间的关系需要进一步调查。工具及其应用方式也存在相当大的差异,但由于骨骼肌质量与完成身体活动的能力密切相关[6,64],因此了解危重疾病、营养支持和恢复之间的关系势在必行,特别是如果大量营养素摄入、氮平衡和肌肉功能之间可能有负面后遗症,例如,营养素摄入越少,肌肉功能反而越好。
7 PICU存活者的喂养困难
挑食和拒食在幼儿中很常见[65-66]。有报道[67]显示:17%的3岁儿童食欲低下,12%被描述为挑食者。已知患有长期疾病的儿童存在喂养困难,包括患有囊性纤维化[68]、胃肠道疾病[69]、食物过敏[70]和先天性心脏病[71]的儿童,其中多达22%的婴儿在手术后喂养受到影响[72],导致父母焦虑和痛苦[73-74]。尽管成人重症监护病房(intensive care unit,ICU)出院后喂养问题的危险因素包括气管插管时间超过48 h、ICU相关营养不良和肌肉无力,但关于入院前其他方面健康的儿童喂养困难的信息很少[75-79]。此外,还有研究[80]报道了成年存活者在ICU出院后长达3个月的食物感知改变和食欲、味觉和食物偏好方面的功能变化。在这一领域需要做更多的工作来了解床边干预是否能减少痛苦的口腔刺激,以及父母的资源和支持是否会减少儿童出院后喂养问题的发生率[75]。
8 未来的研究
目前的研究现状表明:在PICU这个重要领域,缺乏关于营养对临床结局影响的有力证据。2018年,一个专家组[81]调查了该领域需要解决的研究课题,共确定了10个方面的45个研究主题:营养不良在危重疾病中的病理生理学和影响;营养评估,营养风险评估和生物标志物;准确评估危重疾病各阶段的能量需求;蛋白质摄入的作用;药物营养的作用;有效和安全提供EN;肠内喂养不耐受的评估与处理;PN的作用;营养状况和营养治疗对患者长期结局的影响;针对特定人群的营养治疗。在这些课题研究中,有5个研究问题是最迫切需要回答的[81]:1)确定低蛋白质摄入量与高蛋白质摄入量对临床结局的影响;2)确定早期48 h提供蛋白质是否能保持肌肉质量;3)了解早期联合运动和蛋白质补充对维持肌肉质量和功能的作用;4)研究连续与间歇大剂量肠内喂养对临床结局的影响;5)确定服用血管活性药物的儿童在肠内营养期间是否有更高的并发症风险,以及是否存在肠内喂养的“安全剂量”。
PEPaNIC研究已经提供了关于胃肠外途径提供的高蛋白质摄入的作用的数据,这是一个应该避免的选择[26]。今天,未来的试验需要研究通过肠内途径早期提供蛋白质以达到每天1.5 g/kg是否有益[12]。通过使用经过验证的间接量热仪来确定最佳能量摄入量也需要解决[33,82]。此外,EN类型和微量营养素补充也是重要问题(表1)。需要控制良好的随机对照试验来评估营养治疗的作用,还需要观察性研究来更好地了解疾病不同阶段的代谢途径。样本量必须足够,群体不能过于异质性,尽管这些是PICU的主要困难[81]。
Full table
9 结论
随着危重儿童病死率持续下降,生存质量问题越来越受到关注。未来的研究需要确定不同营养支持策略对危重儿童临床和功能结局的影响。
致谢
基金:无。
脚注
来源和同行评议:本文受特邀编辑(Lyvonne Tume,,Frederic Valla和Sascha Verbruggen)委托,为发表在《儿科医学》杂志上的“危重症儿童的营养”系列文章撰写。这篇文章由客座编辑和编辑部组织外部同行评议。
利益冲突:作者完成了ICMJE统一披露表格(可在https://pm.amegroups.com/article/view/10.21037/pm-20-73/coif上获得)。《危重症儿童的营养》系列是由编辑部委托制作的,没有任何资金或赞助。CM博士报告了在提交的工作之外巴克斯特的非财政支持、纽特里西亚的非财政支持。CJC博士报告了在提交的工作之外来自Baxter和Nutricia的非财政支持。作者没有其他利益冲突需要声明。
道德声明:作者对工作的所有方面负责,确保与工作的任何部分的准确性或完整性相关的问题得到适当的调查和解决。
开放获取的声明:这是一篇开放获取的文章,根据知识共享署名-非商业-无衍生4.0国际许可协议(CC BY-NC-ND 4.0)发布。它允许文章的非商业性复制和发布,但严格的条件是不做任何修改或编辑,并且正确引用原始作品(包括通过相关DOI和许可证链接到正式出版)。参见:https://creativecommons.org/licenses/by-nc-nd/4.0/。
References
- Ibiebele I, Algert CS, Bowen JR, et al. Pediatric admissions that include intensive care: a population-based study. BMC Health Serv Res 2018;18:264. [Crossref] [PubMed]
- (PICANET) PICAN. Annual Report 20172017 27 May 2018. Available online: http://www.picanet.org.uk/Audit/Annual-Reporting/PICANet_2017_Annual_Report_Summary_v1.0_FINAL.pdf
- Burns JP, Sellers DE, Meyer EC, et al. Epidemiology of death in the PICU at five U.S. teaching hospitals*. Crit Care Med 2014;42:2101-8. [Crossref] [PubMed]
- Boeddha NP, Schlapbach LJ, Driessen GJ, et al. Mortality and morbidity in community-acquired sepsis in European pediatric intensive care units: a prospective cohort study from the European Childhood Life-threatening Infectious Disease Study (EUCLIDS). Crit Care 2018;22:143. [Crossref] [PubMed]
- Ballot DE, Ramdin T, White DA, et al. A comparison between raw and predicted mortality in a paediatric intensive care unit in South Africa. BMC Res Notes 2018;11:829. [Crossref] [PubMed]
- Lee JH, Choong K. Time to focus on paediatric critical care survivorship. Lancet Respir Med 2019;7:103-5. [Crossref] [PubMed]
- Pollack MM, Wiley JS, Holbrook PR. Early nutritional depletion in critically ill children. Crit Care Med 1981;9:580-3. [Crossref] [PubMed]
- Reid C. Frequency of under-and overfeeding in mechanically ventilated ICU patients: causes and possible consequences. J Hum Nutr Diet 2006;19:13-22. [Crossref] [PubMed]
- Chwals WJ. Overfeeding the critically ill child: fact or fantacy? New Horiz 1994;2:147-55. [PubMed]
- Jacquot A, Valla FV, Mura T, et al. NUTRI-REAPED study: nutritional assessment of French critically ill children and nutrition practice survey in French-speaking pediatric intensive care units. Ann Intensive Care 2019;9:15. [Crossref] [PubMed]
- Bechard LJ, Mehta NM. Nutritional Assessment Must be Prioritized for Critically Ill Children in the PICU. Crit Care Med 2017;45:e464. [Crossref] [PubMed]
- Mehta NM, Bechard LJ, Zurakowski D, et al. Adequate enteral protein intake is inversely associated with 60-d mortality in critically ill children: a multicenter, prospective, cohort study. Am J Clin Nutr 2015;102:199-206. [Crossref] [PubMed]
- Delgado AF, Okay TS, Leone C, et al. Hospital malnutrition and inflammatory response in critically ill children and adolescents admitted to a tertiary intensive care unit. Clinics 2008;63:357-62. [Crossref] [PubMed]
- Botrán M, López-Herce J, Mencía S, et al. Relationship between energy expenditure, nutritional status and clinical severity before starting enteral nutrition in critically ill children. Br J Nutr 2011;105:731-7. [Crossref] [PubMed]
- Valla FV, Berthiller J, Gaillard-Le-Roux B, et al. Faltering growth in the critically ill child: prevalence, risk factors, and impaired outcome. Eur J Pediatr 2018;177:345-53. [Crossref] [PubMed]
- Marino LV, Magee A. A cross-sectional audit of the prevalence of stunting in children attending a regional paediatric cardiology service. Cardiol Young 2016;26:787-9. [Crossref] [PubMed]
- Hulst JM, Joosten KF, Tibboel D, et al. Causes and consequences of inadequate substrate supply to pediatric ICU patients. Curr Opin Clin Nutr Metab Care 2006;9:297-303. [Crossref] [PubMed]
- Hulst J, Joosten KF, Zimmermann LJI, et al. Malnutrition in critically ill children:from admission to 6 months after discharge. Clin Nutr 2004;23:223-32. [Crossref] [PubMed]
- Grippa RB, Silva PS, Barbosa E, et al. Nutritional status as a predictor of duration of mechanical ventilation in critically ill children. Nutrition 2017;33:91-5. [Crossref] [PubMed]
- Ng GYH, Ong C, Wong JJM, et al. Nutritional status, intake, and outcomes in critically ill children with bronchiolitis. Pediatr Pulmonol 2020;55:1199-206. [Crossref] [PubMed]
- Mehta NM, Bechard LJ, Cahill N, et al. Nutritional practices and their relationship to clinical outcomes in critically ill children--an international multicenter cohort study*. Crit Care Med 2012;40:2204-11. [Crossref] [PubMed]
- Marino LV, Griksaitis MJ. Preoperative bioelectrical impedance predicts intensive care length of stay in children following cardiac surgery. Cardiol Young 2018;28:779-82. [Crossref] [PubMed]
- Ventura JC, Hauschild DB, Barbosa E, et al. Undernutrition at PICU admission is predictor of 60-day mortality and PICU length of stay in critically ill children. J Acad Nutr Diet 2020;120:219-29. [Crossref] [PubMed]
- Hulst J, Joosten K, Zimmermann L, et al. Malnutrition in critically ill children: from admission to 6 months after discharge. Clin Nutr 2004;23:223-32. [Crossref] [PubMed]
- Alipoor E, Hosseinzadeh-Attar MJ, Yaseri M, et al. Association of obesity with morbidity and mortality in critically ill children: a systematic review and meta-analysis of observational studies. Int J Obes (Lond) 2019;43:641-51. [Crossref] [PubMed]
- Fivez T, Kerklaan D, Mesotten D, et al. Early versus Late Parenteral Nutrition in Critically Ill Children. N Engl J Med 2016;374:1111-22. [Crossref] [PubMed]
- van Puffelen E, Vanhorebeek I, Joosten KFM, et al. Early versus late parenteral nutrition in critically ill, term neonates: a preplanned secondary subgroup analysis of the PEPaNIC multicentre, randomised controlled trial. Lancet Child Adolesc Health 2018;2:505-15. [Crossref] [PubMed]
- van Puffelen E, Hulst JM, Vanhorebeek I, et al. Outcomes of Delaying Parenteral Nutrition for 1 Week vs Initiation Within 24 Hours Among Undernourished Children in Pediatric Intensive Care: A Subanalysis of the PEPaNIC Randomized Clinical Trial. JAMA Netw Open 2018;1:e182668. [Crossref] [PubMed]
- Jacobs A, Dulfer K, Eveleens RD, et al. Long-term developmental effect of withholding parenteral nutrition in paediatric intensive care units: a 4-year follow-up of the PEPaNIC randomised controlled trial. Lancet Child Adolesc Health 2020;4:503-14. [Crossref] [PubMed]
- Verlinden I, Dulfer K, Vanhorebeek I, et al. Role of age of critically ill children at time of exposure to early or late parenteral nutrition in determining the impact hereof on long-term neurocognitive development: A secondary analysis of the PEPaNIC-RCT. Clin Nutr 2020; [Epub ahead of print]. [PubMed]
- Verstraete S, Vanhorebeek I, van Puffelen E, et al. Leukocyte telomere length in paediatric critical illness: effect of early parenteral nutrition. Crit Care 2018;22:38. [Crossref] [PubMed]
- Güiza F, Vanhorebeek I, Verstraete S, et al. Effect of early parenteral nutrition during paediatric critical illness on DNA methylation as a potential mediator of impaired neurocognitive development: a pre-planned secondary analysis of the PEPaNIC international randomised controlled trial. Lancet Respir Med 2020;8:288-303. [Crossref] [PubMed]
- Larsen BMK, Beggs MR, Leong AY, et al. Can energy intake alter clinical and hospital outcomes in PICU? Clin Nutr ESPEN 2018;24:41-6. [Crossref] [PubMed]
- Vanhorebeek I, Verbruggen S, Casaer MP, et al. Effect of early supplemental parenteral nutrition in the paediatric ICU: a preplanned observational study of post-randomisation treatments in the PEPaNIC trial. Lancet Respir Med 2017;5:475-83. [Crossref] [PubMed]
- Joosten KF, Kerklaan D, Verbruggen SC. Nutritional support and the role of the stress response in critically ill children. Curr Opin Clin Nutr Metab Care 2016;19:226-33. [Crossref] [PubMed]
- Hauschild DB, Ventura JC, Mehta NM, et al. Impact of the structure and dose of protein intake on clinical and metabolic outcomes in critically ill children: A systematic review. Nutrition 2017;41:97-106. [Crossref] [PubMed]
- Bechard LJ, Parrott JS, Mehta NM. Systematic review of the influence of energy and protein intake on protein balance in critically ill children. J Pediatr 2012;161:333-9.e1. [Crossref] [PubMed]
- Wong JJ, Han WM, Sultana R, et al. Nutrition Delivery Affects Outcomes in Pediatric Acute Respiratory Distress Syndrome. JPEN J Parenter Enteral Nutr 2017;41:1007-13. [Crossref] [PubMed]
- Eveleens RD, Joosten KFM, de Koning BAE, et al. Definitions, predictors and outcomes of feeding intolerance in critically ill children: a systematic review. Clin Nutr 2020;39:685-93. [Crossref] [PubMed]
- Silva FM, Bermudes AC, Maneschy IR, et al. Impact of early enteral nutrition therapy on morbimortality reduction in a pediatric intensive care unit: a systematic review. Rev Assoc Med Bras (1992) 2013;59:563-70. [Crossref] [PubMed]
- Mikhailov TA, Kuhn EM, Manzi J, et al. Early enteral nutrition is associated with lower mortality in critically ill children. JPEN J Parenter Enteral Nutr 2014;38:459-66. [Crossref] [PubMed]
- Srinivasan V, Hasbani NR, Mehta NM, et al. Early Enteral Nutrition Is Associated With Improved Clinical Outcomes in Critically Ill Children: A Secondary Analysis of Nutrition Support in the Heart and Lung Failure-Pediatric Insulin Titration Trial. Pediatr Crit Care Med 2020;21:213-21. [Crossref] [PubMed]
- Tume LN, Valla FV, Joosten K, et al. Nutritional support for children during critical illness: European Society of Pediatric and Neonatal Intensive Care (ESPNIC) metabolism, endocrine and nutrition section position statement and clinical recommendations. Intensive Care Med 2020;46:411-25. [Crossref] [PubMed]
- Fayazi S, Adineh M, Zahraei Fard S, et al. Comparing Two Methods of Enteral Nutrition in Terms of their Complications and the Time Needed to Reach Goal Calorie in Children Hospitalized in ICU. Int J Pediatr 2016;4:2119-30. </jrn>.
- Horn D, Chaboyer W. Gastric feeding in critically ill children: a randomized controlled trial. Am J Crit Care 2003;12:461-8. [Crossref] [PubMed]
- Horn D, Chaboyer W, Schluter PJ. Gastric residual volumes in critically ill paediatric patients: a comparison of feeding regimens. Aust Crit Care 2004;17:98-100, 102-3. [Crossref] [PubMed]
- Zhang H, Gu Y, Mi Y, et al. High-energy nutrition in paediatric cardiac critical care patients: a randomized controlled trial. Nurs Crit Care 2019;24:97-102. [Crossref] [PubMed]
- Eveleens RD, Dungen DK, Verbruggen S, et al. Weight improvement with the use of protein and energy enriched nutritional formula in infants with a prolonged PICU stay. J Hum Nutr Diet 2019;32:3-10. [Crossref] [PubMed]
- Marino LV, Eveleens RD, Morton K, et al. Peptide nutrient-energy dense enteral feeding in critically ill infants: an observational study. J Hum Nutr Diet 2019;32:400-8. [Crossref] [PubMed]
- Botrán M, López-Herce J, Mencía S, et al. Enteral nutrition in the critically ill child: comparison of standard and protein-enriched diets. J Pediatr 2011;159:27-32.e1. [Crossref] [PubMed]
- Mehta NM, Compher C A.S.P.E.N.. Clinical Guidelines: nutrition support of the critically ill child. JPEN J Parenter Enteral Nutr 2009;33:260-76. [Crossref] [PubMed]
- McNally JD, Nama N, O'Hearn K, et al. Vitamin D deficiency in critically ill children: a systematic review and meta-analysis. Crit Care 2017;21:287. [Crossref] [PubMed]
- Cariolou M, Cupp MA, Evangelou E, et al. Importance of vitamin D in acute and critically ill children with subgroup analyses of sepsis and respiratory tract infections: a systematic review and meta-analysis. BMJ Open 2019;9:e027666. [Crossref] [PubMed]
- Su G, Jia D. Vitamin D in acute and critically sick children with a subgroup of sepsis and mortality: a meta-analysis. Nut Cancer 2020. [Epub ahead of print].
- Wang Y, Shi C, Yang Z, et al. Vitamin D deficiency and clinical outcomes related to septic shock in children with critical illness: a systematic review. Eur J Clin Nutr 2019;73:1095-101. [Crossref] [PubMed]
- Razavi Khorasani N, Moazzami B, Zahedi Tajrishi F, et al. The association between low levels of vitamin d and clinical outcomes in critically-ill children: a systematic review and meta-analysis. Fetal Pediatr Pathol 2019; [Epub ahead of print]. [PubMed]
- Carcillo JA, Sward K, Halstead ES, et al. A systemic inflammation mortality risk assessment contingency table for severe sepsis. Pediatr Crit Care Med 2017;18:143-50. [Crossref] [PubMed]
- Briassoulis G, Filippou O, Hatzi E, et al. Early enteral administration of immunonutrition in critically ill children: results of a blinded randomized controlled clinical trial. Nutrition 2005;21:799-807. [Crossref] [PubMed]
- Barbosa E, Moreira EA, Goes JE, et al. Pilot study with a glutamine-supplemented enteral formula in critically ill infants. Rev Hosp Clin Fac Med Sao Paulo 1999;54:21-4. [Crossref] [PubMed]
- Jordan I, Balaguer M, Esteban ME, et al. Glutamine effects on heat shock protein 70 and interleukines 6 and 10: Randomized trial of glutamine supplementation versus standard parenteral nutrition in critically ill children. Clin Nutr 2016;35:34-40. [Crossref] [PubMed]
- Ong EG, Eaton S, Wade AM, et al. Randomized clinical trial of glutamine-supplemented versus standard parenteral nutrition in infants with surgical gastrointestinal disease. Br J Surg 2012;99:929-38. [Crossref] [PubMed]
- Yuan X, Qian SY, Li Z, et al. Effect of zinc supplementation on infants with severe pneumonia. World J Pediatr 2016;12:166-9. [Crossref] [PubMed]
- Marino LV, Valla FV, Beattie RM, et al. Micronutrient status during paediatric critical illness: a scoping review. Clin Nutr 2020; [Epub ahead of print]. [Crossref] [PubMed]
- Ong C, Lee JH, Senna S, et al. Body Composition and Acquired Functional Impairment in Survivors of Pediatric Critical Illness. Crit Care Med 2019;47:e445-e453. [Crossref] [PubMed]
- Kerzner B. Clinical investigation of feeding difficulties in young children: a practical approach. Clin Pediatr (Phila) 2009;48:960-5. [Crossref] [PubMed]
- Kerzner B, Milano K, MacLean WC Jr, et al. A practical approach to classifying and managing feeding difficulties. Pediatrics 2015;135:344-53. [Crossref] [PubMed]
- Richman N, Stevenson JE, Graham PJ. Prevalence of behaviour problems in 3-year-old children: an epidemiological study in a London borough. J Child Psychol Psychiatry 1975;16:277-87. [Crossref] [PubMed]
- Duff AJ, Wolfe SP, Dickson C, et al. Feeding behavior problems in children with cystic fibrosis in the UK: prevalence and comparison with healthy controls. J Pediatr Gastroenterol Nutr 2003;36:443-7. [Crossref] [PubMed]
- Haas AM, Maune NC. Clinical presentation of feeding dysfunction in children with eosinophilic gastrointestinal disease. Immunol Allergy Clin North Am 2009;29:65-75. ix. [Crossref] [PubMed]
- Meyer R, Rommel N, Van Oudenhove L, et al. Feeding difficulties in children with food protein-induced gastrointestinal allergies. J Gastroenterol Hepatol 2014;29:1764-9. [Crossref] [PubMed]
- Hill G, Silverman A, Noel R, et al. Feeding dysfunction in single ventricle patients with feeding disorder. Congenit Heart Dis 2014;9:26-9. [Crossref] [PubMed]
- Maurer I, Latal B, Geissmann H, et al. Prevalence and predictors of later feeding disorders in children who underwent neonatal cardiac surgery for congenital heart disease. Cardiol Young 2011;21:303-9. [Crossref] [PubMed]
- Tregay J, Brown K, Crowe S, et al. "I was so worried about every drop of milk" - feeding problems at home are a significant concern for parents after major heart surgery in infancy. Matern Child Nutr 2017;13:e12302. [Crossref] [PubMed]
- Tregay J, Wray J, Crowe S, et al. Going home after infant cardiac surgery: a UK qualitative study. Arch Dis Child 2016;101:320-5. [Crossref] [PubMed]
- Morton K, Marino LV, Pappachan JV, et al. Feeding difficulties in young paediatric intensive care survivors: A scoping review. Clin Nutr ESPEN 2019;30:1-9. [Crossref] [PubMed]
- Leder SB. Incidence and type of aspiration in acute care patients requiring mechanical ventilation via a new tracheotomy. Chest 2002;122:1721-6. [Crossref] [PubMed]
- Tolep K, Getch CL, Criner GJ. Swallowing dysfunction in patients receiving prolonged mechanical ventilation. Chest 1996;109:167-72. [Crossref] [PubMed]
- Skoretz SA, Flowers HL, Martino R. The incidence of dysphagia following endotracheal intubation: a systematic review. Chest 2010;137:665-73. [Crossref] [PubMed]
- Macht M, Wimbish T, Clark BJ, et al. Postextubation dysphagia is persistent and associated with poor outcomes in survivors of critical illness. Crit Care 2011;15:R231. [Crossref] [PubMed]
- Merriweather JL, Salisbury LG, Walsh TS, et al. Nutritional care after critical illness: a qualitative study of patients' experiences. J Hum Nutr Diet 2016;29:127-36. [Crossref] [PubMed]
- Tume LN, Valla FV, Floh AA, et al. Priorities for nutrition research in pediatric critical care. JPEN J Parenter Enteral Nutr 2019;43:853-62. [Crossref] [PubMed]
- Jotterand Chaparro C, Moullet C, Taffé P, et al. Estimation of resting energy expenditure using predictive equations in critically ill children: results of a systematic review. JPEN J Parenter Enteral Nutr 2018;42:976-86. [Crossref] [PubMed]
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Marino LV, Moullet C, Chaparro CJ. A narrative review: the impact of nutrition on clinical outcomes in the critically ill child . Pediatr Med 2020;3:21.


