
儿童人机不同步的特点和管理
1 儿童的人机不同步
机械通气(mechanical ventilation,MV)是儿科重症监护病房中一种常见的、挽救生命的干预措施[1,2]。然而,一些并发症,如呼吸机相关性肺炎、呼吸机诱导的肺损伤(ventilator-induced lung injury,VILI)和通气诱导的隔膜功能障碍(ventilation-induced diaphragm dysfunction,VIDD) [3,4]可能会随之发生。
部分辅助机械通气是治疗危重患者的首选模式[4]。这种在患者和呼吸机之间分配通气的策略,可以通过维持呼吸肌的收缩活动来减少VIDD的发生[5]。然而,必须正确优化患者与呼吸机的交互,以避免VILI和VIDD的发生[6]。人机不同步的特点是患者和呼吸机在呼吸输送时间方面不匹配,其可能由影响患者和呼吸机的多种因素引起(比如镇静水平、患者的呼吸动力、疾病状态和呼吸机设置) [7]。人机不同步的检测至少需要对患者的呼吸模式、气道压力和呼吸机监视器上记录的波形进行仔细的临床检查[8]。然而,有几项限制可能会降低对人机不同步的正确检测:首先,人机不同步可能随时发生,而且目前的技术不可能连续检测它们;其次,医生需要经过专门的培训才能发现它们;再者,某些类型的异步,例如自动触发,无法通过检查压力、流量或体积波形轻易识别。
食管测压法主要用于成人重症监护病房测量食管压力,作为胸膜压力的替代指标,结合流量、压力和容量波形,可以最准确地评估患者与呼吸机的相互作用[9,10]。然而,该技术在成人重症监护中并没有常规应用,仍然局限于儿科患者[11]。
如果人机不同步处理不当,可能会增加VILI、VIDD的风险,从而需要增加镇静作用。这可能会影响机械通气及其所有并发症的持续时间[12]。
在这篇综述中,我们将对不同类型的人机不同步及其潜在的管理进行分类和定义。
2 人机不同步的定义和分类
人机不同步通常根据其发生的呼吸周期的阶段进行分类:触发阶段、吸气、循环停止和呼气阶段[7]。这种分类的使用,使得利用现有的波形进行诊断变得更容易[9]。然而,为了治疗,一种基于引起人机不同步的条件的方法也是有用的。
机械通气期间的呼吸驱动是复杂的,涉及来自中枢和外周化学感受器的反馈信号,如机械感受器以及来自肺、胸壁和呼吸肌的迷走神经输入[13]。呼吸中枢也会受到焦虑和疼痛等其他刺激的影响。
高呼吸驱动可能是由于代谢需求增加或气体交换受损和/或来自肺部受体的强烈机械刺激[14]。相反,低呼吸驱动可能是由于中枢神经系统抑制(镇静)或高通气支持[13]。在呼吸驱动力低(通常与过度辅助有关)和呼吸驱动力高(通常与支持不足有关)的情况下,儿童人机不同步都可能发生[15]。
2.1 低呼吸驱动(过度辅助)
2.1.1 触发延迟、无效触发和延迟循环
在儿童中,压力或流量触发的正常反应时间是0~117 ms。118~234 ms的响应时间可以定义为触发延迟。响应时间>240 ms被认为是无效触发器[12]。然而,在儿童和成人中,无效的触发被定义为伴随着流量减少的气道压力突然下降(0.5 cmH2O),并且在呼气期间没有跟随1个辅助循环(图1)[16],当神经吸气结束后机械吸气继续进行时,就会出现延迟循环(图2)。
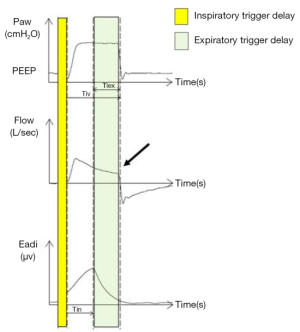
无论是在成人还是儿童中,无效努力都是最常见的人机不同步的类型[16-20]。触发延迟和无效努力的最常见原因是动态高通气,这在儿童阻塞性肺疾病(如毛细支气管炎和支气管发育不良等)中非常常见。过度通气会产生“内源性呼气末正压”(intrinsic positive end expiratory pressure,PEEPi),这代表肺部弹性负荷的增加,患者必须克服这种压力才能触发呼吸。PEEPi的机制是呼气末肺容积大于功能残气量[19-21]。过度触发延迟和无效努力[22-25]可以通过减少过度通气的方法来纠正(例如减少潮气量、降低呼吸频率和呼气时间,以及平衡PEEPi的外部呼气末正压来抵消PEEPi)。
2.1.2 自动触发
第2种最常见的无效努力类型是自动触发,它是在没有吸气努力的情况下由呼吸机进行呼吸(图3)。
自动触发的特点是体积、流量和压力增加,而没有任何患者努力的迹象(压力波形的负偏移)[8]。导致自动触发的机械原因是:呼吸机回路中存在水、空气泄漏和使用低吸气触发阈值。此外,还有与患者相关的原因,例如呼吸驱动力低或呼吸频率降低。事实上,在这些情况下,呼气流量长时间保持为零,有利于由患者努力以外的因素触发。膈肌的电活动(electrical activity of diaphragm,EAdi)可以帮助检测这种不同步。自动触发通常与低呼吸频率和低EAdi(<5 μV)有关[13,14]。临床上可以通过增加触发呼吸机的压力或流量阈值、减少回路中的空气泄漏或增加患者的呼吸动力(比如降低镇静水平或纠正呼吸性碱中毒的原因)来减少这种不同步性。
2.1.3 反向触发
Akoumianaki等[26]首先描述了在接受机械通气的成人中反向触发的发生,这种人机不同步的特点是由呼吸机触发的(而不是由患者)。重度镇静抑制呼吸驱动,似乎与这种不同步有关。Blokpoel等[27]首次报道了11个月大的婴儿因呼吸衰竭而接受被动机械通气的反向触发。然而,需要更多的研究来了解这种不同步在成人和儿童人群中的生理机制和临床影响。
2.2 高呼吸驱动(辅助不足):双触发
理想情况下,患者吸气结束时应与呼吸机呼气阀开启时间重合,以实现被动呼气。在被动通气期间,吸气和呼气阶段是固定的,而在辅助模式期间,吸气结束由呼吸机算法识别。在压力支持通气(pressure support ventilation,PSV)中,当吸气峰值流量降低到阈值(比如吸气峰值的25%)时,循环关闭发生。然而,神经吸气可能比呼吸机输送给定流量所用的时间短或长[28,29]。当呼吸机输送的气流在患者神经吸气结束前停止时,可能会发生“双重触发”(单次吸气后呼吸机输送2次呼吸;图4)。触发发生在连续2次呼吸之间间隔较短的呼气时间(吸气时间的一半或更短)[16]。这种不同步很容易识别,因为不同步呼吸比之前的呼吸短;最终肺容积可显著增加,有助于VILI[30]。
2.3 儿科机械通气
由于幼儿呼吸动力高,ICU呼吸机能否正确检测幼儿的吸气力值得质疑。Marchese等[31]试图通过比较成人和新生儿重症监护呼吸机的性能来解决这个问题,其研究结果表明空气泄漏的存在并不影响触发灵敏度。而Vignaux等[32]证明了当空气泄漏时,呼吸机性能下降。
理想的儿科触发器应该具有快速响应时间,以应对短吸气时间和高呼吸频率,并且应该非常敏感,可以通过适度的努力被激活。同时应避免自动触发、死区效应和必须补偿漏气,尤其是新生儿吸气时间较短,其机械通气时间与神经时间的同步性非常复杂。低潮气量、高呼吸频率、周期性呼吸模式和空气泄漏也会导致神经吸气时间和机械吸气时间之间的不匹配[32-34]。这些因素具有挑战性,尤其是在呼吸触发、循环关闭和呼吸终止方面。
2.4 辅助通气模式
部分支持的模式允许膈肌收缩,并有助于减少VIDD的发生[35,36]。辅助自主呼吸的目的是提供与患者的努力同步并与患者的要求成比例的辅助呼吸[37,38]。实际的新生儿呼吸机一般有辅助控制/压力控制通气(auxiliary control ventilation/pressure controlled ventilation,ACV/PCV)和PSV两种通气模式。在这2种模式下,呼吸的开始都可以由患者的呼吸努力触发;相反,循环由时间(PCV)或流量(PSV)控制,而支持水平由医生确定。
2.5 比例辅助通风模式
比例辅助通气,如神经调节呼吸辅助(neurally adjusted ventilatory assist,NAVA)和比例辅助通气(proportional assisted ventilation,PAV),可以减少患者与呼吸机的不同步性[39],同时按患者的努力程度施加气道压力[40]。
在NAVA期间,触发与EAdi信号相关联。EAdi是通过安装在鼻胃饲管上的电极对阵列记录的隔膜肌电图,其与横膈膜的神经电刺激强度成正比,即与神经换气驱动的强度成正比[14,15]。使用NAVA时,临床医生必须在呼吸机上设置:1)FiO2;2)PEEP;3)辅助水平(或NAVA水平),它决定了EAdi和呼吸机压力之间的比例(以cmH2O为单位)。当EAdi信号达到EAdi峰值的70%时,就会发生从吸气到呼气的循环。
在PAV中,输送的呼吸反而与患者产生的瞬时潮气量和吸气气流成比例增加。在PAV期间,呼吸机使用呼吸系统弹性、流量、气道阻力和阻力无创地计算肌肉力量。因此,呼吸机可以根据设置的PAV百分比,根据所要求的流量和容量计算支持患者所需的压力。此外,随着患者肺部力学的变化,自动测量弹性和阻力的呼吸机可以调整维持PAV百分比所需的压力。通过匹配患者的吸气需求,PAV能够在吸气开始时改善患者与呼吸机的相互作用。与PSV不同的是,当压力达到目标水平时,流量会减速。
Schulze等[41]对36名出生体重在600~1 200 g的婴儿进行了PAV、ACV和间歇强制通气(intermittent mandatory ventilation,IMV)的随机比较。PAV能够在较低的气道压力下维持类似的气体交换(根据指标变量降低15%至44%;P<0.05)。氧合指数从ACV中的2.1(1.7,3.3)和IMV期间的2.3(1.7,3.1)降至PAV中的1.8(1.3,2.3)(P<0.05)。
Musante等[42]也表明:与持续正压通气(continuous positive airway pressure,CPAP)相比,PAV能够减少10例早产儿的胸腹不同步和胸壁变形。这是通过在CPAP水平以上增加3.8~7.6 cmH2O来实现的。尽管有这些研究,但目前不建议体重低于20 kg的患者使用PAV。
NAVA技术使用一种特殊的鼻胃管,在其远端附近有一系列电极,导管必须穿过横膈膜以检测收缩期间横膈膜的电活动。它的使用改善了成人和儿童患者与呼吸机的相互作用[43]。与PAV类似,呼吸机和患者按比例分担通气量。与PAV相反,NAVA大大改善了吸气触发,因为呼吸机在膈膜被“电”刺激时提供呼吸。新生儿和儿科患者的EAdi监测似乎可以改善NAVA和其他呼吸模式通气中患者-呼吸机不同步的检测[44-48]。Beck等[47]报道了7例低出生体重新生儿即使存在大的漏气,患者与呼吸机的相互作用也得到改善。他们还发现:在NAVA期间,常规通气组新生儿机械和神经吸气时间相近,而常规通气组的循环停止时间比NAVA组早120 ms。呼气时间和呼吸频率更短。Bengtsson等[48]在一项4 h的NAVA试验中发现:与PSV相比,16名儿童的患者-呼吸机交互改善;NAVA开始时峰值气道压力下降了28%,NAVA 3 h后峰值气道压力下降了32%,平均气道压力、分钟通气量、呼气潮气量、呼吸频率、心率、PaO2、PaCO2没有变化。该研究未显示任何患者或设备不良事件。Bordessoule等[49]评估了10例婴儿的NAVA、PCV和PSV,结果显示:在PCV和PSV中,分别有4%和6.5%的神经活动没有触发呼吸机;相反,在NAVA中,所有的吸气努力都被触发了。PCV(193 ms)和PSV(135 ms)的触发吸气延迟高于NAVA(93 ms),PCV和PSC的呼吸机在神经吸气结束前停止循环(分别占12%和21%)。
3 结论
人机不同步是机械通气的常见事件。不同类型的不同步的发生由不同的生理原因引起,因此管理也需要相应地改变。我们关于儿科人机不同步的知识来自小型且有限的观察性研究,因此需要精确的流行病学数据。未来的儿科研究应该评估在床边持续监测不同步症状的真正益处(食管导管或EAdi)以增加其检测,并评估这种方法是否会影响最终结果(减少无机械通气的天数和生存率)。
Acknowledgments
Funding: None.
Footnote
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at https://pm.amegroups.com/article/view/10.21037/pm.2019.08.05/coif). MDN serves as an unpaid editorial board member of Pediatric Medicine from Jul 2018 to Jun 2020. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Briassoulis G, Filippou O, Natsi L, et al. Acute and chronic paediatric intensive care patients: current trends and perspectives on resource utilization. QJM 2004;97:507-18. [Crossref] [PubMed]
- Martinot A, Leteurtre S, Grandbastien B, et al. Characteristics of patients and use of resource in French pediatric intensive care units. Le groupe francophone de Rèanimation et urgences pédiatriques. Arch Pediatr 1997;4:730-6. [Crossref] [PubMed]
- Vassilakopoulos T, Petrof BJ. Ventilator-induced diaphragmatic dysfunction. Am J Respir Crit Care Med 2004;169:336-41. [Crossref] [PubMed]
- Goligher EC, Fan E, Herridge MS, et al. Evolution of Diaphragm Thickness during Mechanical Ventilation. Impact of Inspiratory Effort. Am J Respir Crit Care Med 2015;192:1080-8. [Crossref] [PubMed]
- Martin AD, Joseph AM, Beaver TM, et al. Effect of intermittent phrenic nerve stimulation during cardiothoracic surgery on mitochondrial respiration in the human diaphragm. Crit Care Med 2014;42:e152-6. [Crossref] [PubMed]
- Goligher EC, Brochard LJ, Reid WD, et al. Diaphragmatic myotrauma: a mediator of prolonged ventilation and poor patient outcomes in acute respiratory failure. Lancet Respir Med 2019;7:90-8. [Crossref] [PubMed]
- Kondili E, Prinianakis G, Georgopoulos D. Patient-ventilator interaction. Br J Anaesth 2003;91:106-19. [Crossref] [PubMed]
- Georgopoulos D, Prinianakis G, Kondili E. Bedside waveforms interpretation as a tool to identify patient-ventilator asynchronies. Intensive Care Med 2006;32:34-47. [Crossref] [PubMed]
- Colombo D, Cammarota G, Alemani M, et al. Efficacy of ventilator waveforms observation in detecting patient-ventilator asynchrony. Crit Care Med 2011;39:2452-7. [Crossref] [PubMed]
- de Wit M. Monitoring of patient-ventilator interaction at the bedside. Respir Care 2011;56:61-72. [Crossref] [PubMed]
- Cheifetz IM. Pediatric ARDS. Respir Care 2017;62:718-31. [Crossref] [PubMed]
- Blokpoel RG, Burgerhof JG, Markhorst DG, et al. Patient-Ventilator Asynchrony During Assisted Ventilation in Children. Pediatr Crit Care Med 2016;17:e204-11. [Crossref] [PubMed]
- Georgopoulos D, Roussos C. Control of breathing in mechanically ventilated patients. Eur Respir J 1996;9:2151-60. [Crossref] [PubMed]
- Brochard L, Slutsky A, Pesenti A. Mechanical Ventilation to Minimize Progression of Lung Injury in Acute Respiratory Failure. Am J Respir Crit Care Med 2017;195:438-42. [Crossref] [PubMed]
- Pham T, Telias I, Piraino T, et al. Asynchrony Consequences and Management. Crit Care Clin 2018;34:325-41. [Crossref] [PubMed]
- Thille AW, Rodriguez P, Cabello B, et al. Patient-ventilator asynchrony during assisted mechanical ventilation. Intensive Care Med 2006;32:1515-22. [Crossref] [PubMed]
- Piquilloud L, Vignaux L, Bialais E, et al. Neurally adjusted ventilatory assist improves patient-ventilator interaction. Intensive Care Med 2011;37:263-71. [Crossref] [PubMed]
- Chao DC, Scheinhorn DJ, Stearn-Hassenpflug M. Patient-ventilator trigger asynchrony in prolonged mechanical ventilation. Chest 1997;112:1592-9. [Crossref] [PubMed]
- de Wit M, Pedram S, Best AM, et al. Observational study of patient-ventilator asynchrony and relationship to sedation level. J Crit Care 2009;24:74-80. [Crossref] [PubMed]
- Blanch L, Villagra A, Sales B, et al. Asynchronies during mechanical ventilation are associated with mortality. Intensive Care Med 2015;41:633-41. [Crossref] [PubMed]
- Beck J, Gottfried SB, Navalesi P, et al. Electrical activity of the diaphragm during pressure support ventilation in acute respiratory failure. Am J Respir Crit Care Med 2001;164:419-24. [Crossref] [PubMed]
- Nava S, Bruschi C, Rubini F, et al. Respiratory response and inspiratory effort during pressure support ventilation in COPD patients. Intensive Care Med 1995;21:871-9. [Crossref] [PubMed]
- Smith TC, Marini JJ. Impact of PEEP on lung mechanics and work of breathing in severe airflow obstruction. J Appl Physiol (1985) 1988;65:1488-99. [PubMed]
- Mancebo J, Albaladejo P, Touchard D, et al. Airway occlusion pressure to titrate positive end-expiratory pressure in patients with dynamic hyperinflation. Anesthesiology 2000;93:81-90. [Crossref] [PubMed]
- MacIntyre NR, Cheng KC, McConnell R. Applied PEEP during pressure support reduces the inspiratory threshold load of intrinsic PEEP. Chest 1997;111:188-93. [Crossref] [PubMed]
- Akoumianaki E, Lyazidi A, Rey N, et al. Mechanical ventilation-induced reverse-triggered breaths: a frequently unrecognized form of neuromechanical coupling. Chest 2013;143:927-38. [Crossref] [PubMed]
- Blokpoel RGT, Wolthuis DW, Koopman AA, et al. Reverse Triggering: A Novel Type of Patient-Ventilator Asynchrony in Mechanically Ventilated Children. Am J Respir Crit Care Med 2019;200:e4-e5. [Crossref] [PubMed]
- Ranieri VM, Giuliani R, Mascia L, et al. Patient-ventilator interaction during acute hypercapnia: pressure-support vs. proportional-assist ventilation. J Appl Physiol (1985) 1996;81:426-36. [PubMed]
- Yamada Y, Du HL. Analysis of the mechanisms of expiratory asynchrony in pressure support ventilation: a mathematical approach. J Appl Physiol (1985) 2000;88:2143-50. [PubMed]
- Yoshida T, Fujino Y, Amato MB, et al. Fifty Years of Research in ARDS. Spontaneous Breathing during Mechanical Ventilation. Risks, Mechanisms, and Management. Am J Respir Crit Care Med 2017;195:985-92. [Crossref] [PubMed]
- Marchese AD, Chipman D, de la Oliva P, et al. Adult ICU ventilators to provide neonatal ventilation: a lung simulator study. Intensive Care Med 2009;35:631-8. [Crossref] [PubMed]
- Vignaux L, Piquilloud L, Tourneux P, et al. Neonatal and adult ICU ventilators to provide ventilation in neonates, infants, and children: a bench model study. Respir Care 2014;59:1463-75. [Crossref] [PubMed]
- Keszler M. State of the art in conventional mechanical ventilation. J Perinatol 2009;29:262-75. [Crossref] [PubMed]
- Bhandari V. Synchronized ventilation in neonates: a brief review. Neonatology Today 2011;6:1-6.
- Petrof BJ, Jaber S, Matecki S. Ventilator-induced diaphragmatic dysfunction. Curr Opin Crit Care 2010;16:19-25. [Crossref] [PubMed]
- Slutsky AS. Lung injury caused by mechanical ventilation. Chest 1999;116:9S-15S. [Crossref] [PubMed]
- Sinderby C, Beck J. Neurally adjusted ventilatory assist (NAVA): An update and summary of experiences. Neth J Crit Care 2007;11:243-52.
- Beck J, Campoccia F, Allo JC, et al. Improved synchrony and respiratory unloading by neurally adjusted ventilatory assist (NAVA) in lung-injured rabbits. Pediatr Res 2007;61:289-94. [Crossref] [PubMed]
- Schmidt M, Kindler F, Cecchini J, et al. Neurally adjusted ventilatory assist and proportional assist ventilation both improve patient-ventilator interaction. Crit Care 2015;19:56. [Crossref] [PubMed]
- Lellouche F, Brochard L. Advanced closed loops during mechanical ventilation (PAV, NAVA, ASV, SmartCare). Best Pract Res Clin Anaesthesiol 2009;23:81-93. [Crossref] [PubMed]
- Schulze A, Gerhardt T, Musante G, et al. Proportional assist ventilation in low birth weight infants with acute respiratory disease: A comparison to assist/control and conventional mechanical ventilation. J Pediatr 1999;135:339-44. [Crossref] [PubMed]
- Musante G, Schulze A, Gerhardt T, et al. Proportional assist ventilation decreases thoracoabdominal asynchrony and chest wall distortion in preterm infants. Pediatr Res 2001;49:175-80. [Crossref] [PubMed]
- Sinderby C, Beck J. Proportional assist ventilation and neurally adjusted ventilatory assist--better approaches to patient ventilator synchrony?. Clin Chest Med 2008;29:329-42. vii. [Crossref] [PubMed]
- Breatnach C, Conlon NP, Stack M, et al. A prospective crossover comparison of neurally adjusted ventilatory assist and pressure-support ventilation in a pediatric and neonatal intensive care unit population. Pediatr Crit Care Med 2010;11:7-11. [Crossref] [PubMed]
- Alander M, Peltoniemi O, Pokka T, et al. Comparison of pressure-, flow-, and NAVA-triggering in pediatric and neonatal ventilatory care. Pediatr Pulmonol 2012;47:76-83. [Crossref] [PubMed]
- Clement KC, Thurman TL, Holt SJ, et al. Neurally triggered breaths reduce trigger delay and improve ventilator response times in ventilated infants with bronchiolitis. Intensive Care Med 2011;37:1826-32. [Crossref] [PubMed]
- Beck J, Reilly M, Grasselli G, et al. Patient-ventilator interaction during neurally adjusted ventilatory assist in low birth weight infants. Pediatr Res 2009;65:663-8. [Crossref] [PubMed]
- Bengtsson JA, Edberg KE. Neurally adjusted ventilatory assist in children: an observational study. Pediatr Crit Care Med 2010;11:253-7. [Crossref] [PubMed]
- Bordessoule A, Emeriaud G, Morneau S, et al. Neurally adjusted ventilatory assist improves patient–ventilator interaction in infants as compared with conventional ventilation. Pediatr Res 2012;72:194-202. [Crossref] [PubMed]

袁宵潇。中共党员,复旦大学附属儿科医院内分泌科2020级在读博士。曾任2018级研究生党支部副书记。荣获复旦大学冠名奖学金、优秀学生干部、优秀学生、优秀团员、枫林研究生会先进工作者、儿科医院优秀党务工作者。(更新时间:2021/7/14)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Lonero M, Di Nardo M. Features and management of asynchronies in children . Pediatr Med 2019;2:50.




